
已知有以下物質相互轉化
試回答:(1)寫出E的化學式 ,H的化學式 。
(2)寫出由E轉變成F的化學方程式 。
(3)檢驗G溶液中的金屬陽離子的方法是: ;
向G溶液加入A的有關離子反應方程式 。
(4)寫出A在一定條件下與水反應的化學方程式 。
(1)Fe(OH)2 AgCl(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)取少量G溶液于試管中,向試管中滴加少量KSCN溶液,若出現紅色,則證明溶液中有Fe3+;2Fe3++Fe=3Fe2+
(4)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
解析試題分析:(1)焰色反應顯紫色,說明D溶液中含有K元素。又因為D能和硝酸銀溶液反應生成白色沉淀氯化銀,所以D應該是氯化鉀。EF的轉化以及沉淀顏色可知,E是氫氧化亞鐵、F是氫氧化鐵,G則氯化鐵。B和C反應生成氯化鉀和氫氧化亞鐵,所以BC是氫氧化鉀和氯化亞鐵。G能和A反應生成B,所以A是鐵,B是氯化亞鐵,C是氫氧化鉀,氣體是氫氣。
(2)由E轉變成F,即Fe(OH)2轉化為Fe(OH)3,化學方程式為:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)檢驗G溶液中的金屬陽離子,即檢驗Fe3+,可用KSCN溶液檢驗;向G溶液加入A,Fe3+被Fe還原為Fe2+,離子方程式為:2Fe3++Fe=3Fe2+。
(4)Fe在高溫條件下與水蒸氣反應生成Fe3O4和H2,化學方程式為3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
考點:本題考查無機框圖的分析與推斷、方程式的書寫、離子的檢驗。


 口算小狀元口算速算天天練系列答案
口算小狀元口算速算天天練系列答案 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:填空題
以黃銅礦(主要成分為CuFeS2,含少量雜質SiO2等)為原料進行煉銅,同時得到副產品綠礬(FeSO4·7H2O)。其主要流程如下: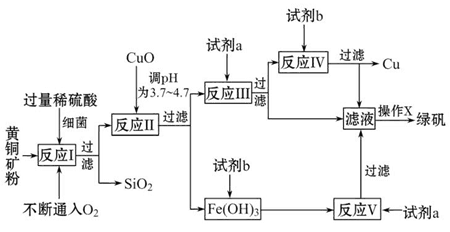
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分陽離子以氫氧化物形式開始沉淀和完全沉淀時溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
現有Fe、Cu組成的合金,其中Cu、Fe的總物質的量為a mol,Cu的物質的量分數為x;研成粉末后,全部投入含b mol HNO 的稀溶液中,微熱使其充分反應,且硝酸的還原產物只有NO,試回答下列問題:
的稀溶液中,微熱使其充分反應,且硝酸的還原產物只有NO,試回答下列問題:
(1)若剩余的殘渣只有Cu,則溶液中含有的金屬離子為__________。(寫出所有可能情況)
(2)當溶液中金屬離子只有Fe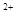 、Cu
、Cu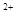 時,則b的取值范圍是(用a、x表示)___________。
時,則b的取值范圍是(用a、x表示)___________。
(3)當x=0.5,溶液中Fe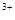 與Fe
與Fe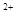 的物質的量相等時,在標準狀況下共產生672 mL氣體。則a=____________、b=_____________。
的物質的量相等時,在標準狀況下共產生672 mL氣體。則a=____________、b=_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鋁是一種應用廣泛的金屬,工業上用Al2O3和冰晶石(Na3AlF6)混合熔融電解制得。
①鋁土礦的主要成分是Al2O3和SiO2等。從鋁土礦中提煉Al2O3的流程如下:
②以螢石(CaF2)和純堿為原料制備冰晶石的流程如下: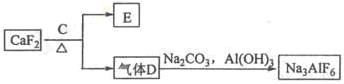
回答下列問題:
(1)寫出反應1的化學方程式 ;
(2)濾液Ⅰ中加入CaO生成的沉淀是 ,反應2的離子方程式為 ;
(3)E可作為建筑材料,化合物C是 ,寫出由D制備冰晶石的化學方程式 ;
(4)電解制鋁的化學方程式是 ,以石墨為電極,陽極產生的混合氣體的成分是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鐵元素及其化合物與人類的生產生活息息相關,試回答下列問題:
(1)電子工業常用30%的FeCl3溶液腐蝕敷在絕緣板上的銅箔,制造印刷電路板,該反應的離子方程式為 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
則高爐煉鐵過程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)鐵紅(Fe2O3)是一種紅色顏料。將一定量的鐵紅溶于160mL 5 mol·L-1鹽酸中,再加入足量鐵粉,待反應結束共收集到氣體2.24L(標準狀況),經檢測溶液中無Fe3+,則參加反應的鐵粉的質量為 。
(4)以H2、O2、熔融鹽Na2CO3組成燃料電池,采用電解法制備Fe(OH)2,裝置如下圖所示,其中P端通入CO2。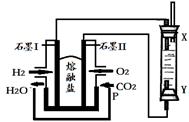
①石墨I電極上的電極反應式為 。
②通電一段時間后,右側玻璃管中產生大量的白色沉淀,且較長時間不變色。則下列說法中正確的是 (填序號)。
| A.X、Y兩端都必須用鐵作電極 |
| B.可以用NaOH溶液作為電解液 |
| C.陰極發生的反應是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在陽極上產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現下圖所示的物質之間的變化: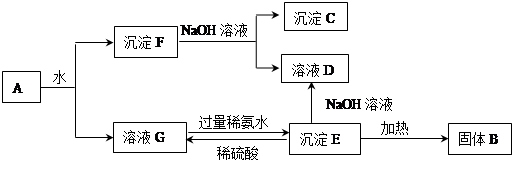
據此回答下列問題:
(1)圖中涉及分離溶液與沉淀的方法是__________________。
(2)B、C、D 三種物質的化學式為:B_________ C_________ D_________
(3)沉淀E與稀硫酸反應的離子方程式為________________________________________。
(4)將沉淀F中存在的兩種金屬元素組成的合金溶于100 mL 4mol/LHCl溶液中,然后再滴加1 mol/L NaOH溶液,沉淀質量m隨加入NaOH溶液的體積V變化如下圖所示。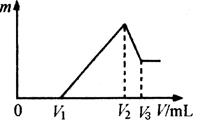
已知V1=160mL。根據以上信息回答:
①_________(填“能”或“不能”)計算出V3
②V2為_________mL(若能算出具體數字,請在橫線上填寫具體數字;若不能請在橫線上填“不能確定”)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
據新華社報道,發展改革委員會于2007年4月發出“遏制鋁冶煉投資反彈”的緊急通知。原因是鋁冶煉屬高耗能產業,而且某些鋁冶煉企業以污染環境為代價,得不償失。
如圖是傳統的工業生產金屬鋁的基本流程圖,閱讀上述新聞信息,結合鋁生產的流程圖解答下列問題: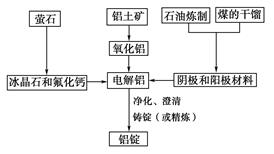
請回答:
(1)工業冶煉金屬鋁用的是鋁土礦,鋁土礦的主要成分是________(填化學式)。石油煉制和煤的干餾產品____________(填物質名稱)作電解鋁的陰極和陽極材料。
(2)氧化鋁熔點高達2050 ℃,工業上為了降低能量消耗,在金屬鋁的冶煉中采取的措施是__________________________。
(3)在冶煉過程中,陽極材料需要定期地進行更換,原因是該極材料不斷被消耗,產生這種現象的原因是:__________________________________________(用化學方程式表示)。
(4)工業上制取金屬鎂時是電解MgCl2,電解反應方程式為_________________,鎂和鋁都是活潑金屬,為什么在電解冶煉過程中,一個用氯化物,一個用氧化物?原因是:
________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知A、B、C、D為常見單質,其中B、C、D常溫常壓下為氣體,甲、乙、丙、丁為化合物,乙常溫下為液體,丙的焰色反應為黃色,下圖為各種物質之間的相互反應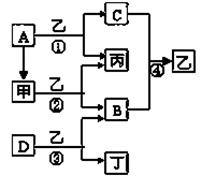
(1)寫出下列物質的化學式:
A ,B ,D ,丙 。
(2)丙電子式為 ,反應②中若有11.2L(標準狀況下)B生成,則發生轉移的電
子的物質的量為 。
(3)寫出反應③的化學方程式:
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鋁元素在自然界中主要存在于鋁土礦(主要成分為Al2O3,還含有Fe2O3、FeO、SiO2)中。工業上用鋁土礦制備鋁的某種化合物的工藝流程如下。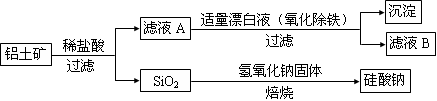
(1)在濾液A中加入漂白液,目的是氧化除鐵,所得濾液B顯酸性。
①檢驗濾液B中是否還含有鐵元素的方法為: (注明試劑、現象)。
②將濾液B中的鋁元素以沉淀形式析出,可選用的最好試劑為 (填代號)。
a.氫氧化鈉溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由濾液B制備氯化鋁晶體涉及的操作為:邊滴加濃鹽酸邊蒸發濃縮、冷卻結晶、 (填操作名稱)、洗滌。
④該過程中涉及某氧化還原反應如下,請完成:
□Fe2++ □ClO-+ □ = □Fe(OH)3↓+ □C1-+ □ 。
(2)SiO2和NaOH焙燒制備硅酸鈉,可采用的裝置為 (填代號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com