
(1)已知: C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
則反應CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= ____ ___kJ/mol。
(2)在一恒容的密閉容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能說明該反應已達到平衡狀態的是_______(填序號)。
A.每消耗1 mol CO的同時生成2molH2
B.混合氣體總物質的量不變
C.生成CH3OH的速率與消耗CO的速率相等
D.CH3OH、CO、H2的濃度都不再發生變化
②CO的平衡轉化率(α)與溫度、壓強的關系如圖所示。A、B兩點的平衡常數K(A)_______K(B)(填“>”、“=”或“<”,下同);由圖判斷ΔH _____0。
③某溫度下,將2.0 mol CO和6.0 molH2充入2 L的密閉容器中,充分反應后,達到平衡時測得c(CO)="0.25" mol/L,則CO的轉化率= ,此溫度下的平衡常數K= (保留二位有效數字)。
(3)工作溫度650℃的熔融鹽燃料電池,用煤炭氣(CO、H2)作負極反應物,空氣與CO2的混合氣體為正極反應物,催化劑鎳作電極,用一定比例的Li2CO3和Na2CO3低熔點混合物作電解質。負極的電極反應式為:CO+H2-4e-+2CO32-=3CO2+H2O;則該電池的正極反應式為 。
(1)-524.8(2分)
(2)①c(2分);② =(2分);<(2分);③75%(3分); 1.3(2分)
(3)O2+4e-+2CO2=2CO32-(2分)
解析試題分析: (1)根據蓋斯定律和已知方程式可得,ΔH=ΔH1-ΔH2 =-393.5 kJ/mol-131.3 kJ/mol="-524.8" kJ/mol。
(2)①A項每消耗1 mol CO的同時生成2molH2 表示的是正逆反應速率相等,所以反應達到平衡。
B.根據反應方程式中氣體系數可知,該反應是前后氣體的減少的反應,所以混合氣體總物質的量不變時,反應達到平衡,B正確;
C.生成CH3OH的速率與消耗CO的速率均表示正反應速率,不能說明反應達平衡,C錯誤;
D.反應中各物質的濃度不再變化是化學反應達到平衡的重要標志,D正確。
②反應的平衡常數只與溫度有關,所以圖像中A、B的溫度相等,所以平衡常數也相等,即K(A)= K(B);又可看出圖像曲線隨著溫度升高,CO的轉化率不斷降低,所以溫度升高對正反應不利,使平衡逆向移動,所以該反應的正反應是一個放熱反應,ΔH <0。
③ CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
初始濃度(mol/L):1 3 0
轉化濃度(mol/L):0.75 2.25 0.75
平衡濃度(mol/L):0.25 0.75 0.75
所以H2的轉化率=0.75÷1×100%=75%
平衡常數K= c(CH3OH) / c(CO)c2(H2) ="0.75/" 0.752 0.25=1.3
(3)該電池的反應原理實質是用水煤氣做燃料,制成一個燃料電池,所以電池總反應式就是水煤氣的燃燒反應CO+H2 +O2=CO2+H2O,可以看出Li2CO3和Na2CO3只是做電解質并沒有發生反應,所以根據已知得負極反應式消耗CO32-可推得正極反應式應生成CO32-,所以可得正極反應式為O2+4e-+2CO2=2CO32- 。
考點:本題考查的是化學反應原理的知識,設計蓋斯定律的應用計算、化學平衡標志的判斷、轉化率和化學平衡常數的計算、電化學方程式的書寫等內容。


科目:高中化學 來源: 題型:填空題
某實驗小組設計用50 mL 1.0 mol/L鹽酸跟50 mL 1.1 mol/L 氫氧化鈉溶液在如圖裝置中進行中和反應。在大燒杯底部墊碎泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平。然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過。通過測定反應過程中所放出的熱量可計算中和熱。試回答下列問題: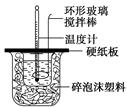
(1)本實驗中用稍過量的NaOH的原因教材中說是為保證鹽酸完全被中和。試問:鹽酸在反應中若因為有放熱現象,而造成少量鹽酸在反應中揮發,則測得的中和熱____________(填“偏大”、“偏小”或“不變”)。
(2)在中和熱測定實驗中存在用水洗滌溫度計上的鹽酸的步驟,若無此操作步驟,則測得的中和熱會____________(填“偏大”、“偏小”或“不變”)。
(3)若用等濃度的醋酸與NaOH溶液反應,則測得的中和熱會____________(填“偏大”、“偏小”或“不變”),其原因是_______________________________________________。
(4)該實驗小組做了三次實驗,每次取溶液各50 mL,并記錄下原始數據(見下表)。
| 實驗序號 | 起始溫度t1/℃ | 終止溫度(t2)/℃ | 溫差(t2-t1)/℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ已知在常溫常壓下:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H=_1275.6kJ?mol-1
②H2O(l)═H2O(g) △H=+44.0kJ?mol-1寫出表示甲醇燃燒熱的熱化學方程式: 。
Ⅱ.甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定條件下,向體積為2L的恒容密閉容器中充入1molCH3OH(g)和3molH2O(g),20s后,測得混合氣體的壓強是反應前的1.2倍,則用甲醇表示該反應的速率為 。
(2)判斷⑴中可逆反應達到平衡狀態的依據是(填序號) 。
①v正(CH3OH) = 3v逆(H2) ②混合氣體的密度不變 ③混合氣體的平均相對分子質量不變 ④CH3OH、H2O、CO2、H2的濃度都不再發生變化 ⑤CO2和H2的濃度之比為1:3
(3)圖中P是可自由平行滑動的活塞,關閉K,在相同溫度時,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),兩容器分別發生上述反應。 已知起始時容器A和B的體積均為aL,反應達到平衡時容器B的體積為1.5aL,容器B中CH3OH轉化率為 ;維持其他條件不變,若打開K一段時間后重新達到平衡,容器B的體積為 L(連通管中氣體體積忽略不計,且不考慮溫度的影響)。
Ⅲ.如圖甲、乙是電化學實驗裝置。請回答下列問題:
(1)若兩池中均盛放CuSO4溶液
①甲池中石墨棒上的電極反應式為____________________.
②如果起始時乙池盛有200mL CuSO4溶液,電解一段時間后溶液藍色變淺,若要使溶液恢復到電解前的狀態,需要向溶液中加入0.8g CuO,則其電解后的pH為 (忽略溶液體積的變化)。
(2)若甲池中盛放飽和NaCl溶液,則甲池中石墨棒上的電極反應式為__________________.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
能源的開發利用與人類社會的可持續發展息息相關。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+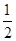 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
則C的燃燒熱ΔH=________ kJ·mol-1。
Ⅱ.(1)依據原電池的構成原理,下列化學反應在理論上可以設計成原電池的是________(填序號)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3與CO2為反應的環境,依據所選反應設計成一個原電池,請寫出該原電池的負極反應:____________________________________________________________。
(2)某實驗小組模擬工業合成氨反應N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,開始他們將N2和H2混合氣體20 mol(體積比1∶1)充入5 L合成塔中,反應前壓強為p0,反應過程中壓強用p表示,反應過程中
2NH3(g) ΔH=-92.4 kJ·mol-1,開始他們將N2和H2混合氣體20 mol(體積比1∶1)充入5 L合成塔中,反應前壓強為p0,反應過程中壓強用p表示,反應過程中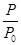 與時間t的關系如圖所示。
與時間t的關系如圖所示。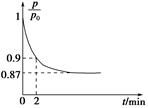
請回答下列問題:
①反應達平衡的標志是(填字母代號)________。
A.壓強保持不變
B.氣體密度保持不變
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min內,以c(N2)變化表示的平均反應速率為________。
③欲提高N2的轉化率,可采取的措施有________。
A.向體系中按體積比1∶1再充入N2和H2
B.分離出NH3
C.升高溫度
D.充入氦氣使壓強增大
E.加入一定量的N2
(3)25 ℃時,BaCO3和BaSO4的溶度積常數分別是8×10-9和1×10-10,某含有BaCO3沉淀的懸濁液中,c(CO32-)=0.2 mol·L-1,如果加入等體積的Na2SO4溶液,若要產生BaSO4沉淀,加入Na2SO4溶液的物質的量濃度最小是________ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中國政府承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效減碳的手段之一是節能,下列制氫方法最節能的是 。
A.電解水制氫:2H2O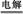 2H2↑+O2↑
2H2↑+O2↑
B.高溫使水分解制氫:2H2O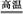 2H2↑+O2↑
2H2↑+O2↑
C.太陽光催化分解水制氫:2H2O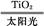 2H2↑+O2↑
2H2↑+O2↑
D.天然氣制氫:CH4+H2O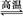 CO+3H2
CO+3H2
(2)CO2可轉化成有機物實現碳循環。在體積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,一定條件下反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。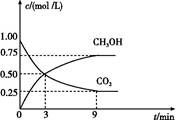
①從3 min到9 min,v(H2)= mol/(L·min)。
②能說明上述反應達到平衡狀態的是 (填編號)。
A.反應中CO2與CH3OH的物質的量濃度之比為1∶1(即圖中交叉點)
B.混合氣體的密度不隨時間的變化而變化
C.單位時間內消耗3 mol H2,同時生成1 mol H2O
D.CO2的體積分數在混合氣體中保持不變
(3)工業上,CH3OH也可由CO和H2合成。參考合成反應CO(g)+2H2(g) CH3OH(g)的平衡常數:
CH3OH(g)的平衡常數:
| 溫度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常數 | 667 | 13 | 1.9×1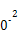 | 2.4×1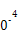 | 1×1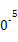 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某種優質燃油由甲、乙兩種有機物混合而成,甲、乙兩種物質含有C、H、O三種元素中的兩種或三種。已知甲、乙及CO、H2的燃燒熱如下:
| 物質 | 甲 | 乙 | CO | H2 |
| 燃燒熱/(kJ·mol-1) | 1 366 | 5 518 | 283 | 286 |
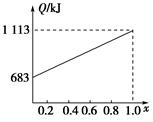
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)甲醇是一種重要的化工產品,可利用甲醇催化脫氫制備甲醛。甲醛與氣態甲醇轉化的能量關系如圖所示。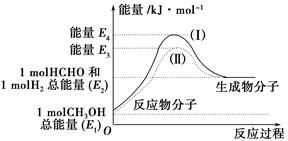
反應過程中的能量關系
①甲醇催化脫氫轉化為甲醛的反應是________(填“吸熱”或“放熱”)反應。
②過程Ⅰ與過程Ⅱ的反應熱是否相同?____________原因是__________________________________。
③寫出甲醇催化脫氫轉化為甲醛的熱化學反應方程式________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+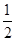 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列說法正確的是________。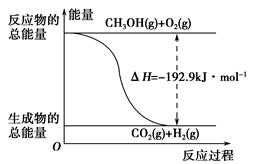
| A.CH3OH轉變成H2的過程一定要吸收能量 |
| B.①反應中,反應物的總能量高于生成物的總能量 |
C.根據②推知反應:CH3OH(l)+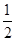 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反應②的能量變化如圖所示 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇是一種重要的可再生能源,工業上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,還需要知道反應(用化學方程式表示) 的焓變。
(2)在Cu2O/ZnO做催化劑的條件下,將CO(g)和H2(g)充入容積為2L的密閉容器中合成CH3OH(g),反應過程中,CH3OH的物質的量(n)與時間(t)及溫度的關系如圖。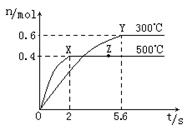
根據題意回答下列問題:
①反應達到平衡時,平衡常數表達式K= ;
升高溫度,K值 (填“增大”、“減小”
或“不變”)。
②在500℃,從反應開始到平衡,氫氣的平均反應速率v(H2)= 。
③若其它條件不變,對處于Z點的體系,將體積壓縮至原來的1/2,達到新的平衡后,下列有關該體系的說法正確的是 。
a.氫氣的濃度與原平衡比減少 b.正、逆反應速率都加快
c.甲醇的物質的量增加 d.重新平衡時n(H2) /n(CH3OH)增大
④據研究,反應過程中起催化作用的為Cu2O,反應體系中含少量的CO2有利于維持Cu2O的量不變,原因是: (寫出相關的化學方程式并輔以必要的文字說明)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)已知反應及幾種物質中化學鍵斷裂時的能量變化如下所示:
H2(g)+Cl2(g)=2HCl(g) △H=-184kJ/mol
4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g) △H=-115.6kJ/mol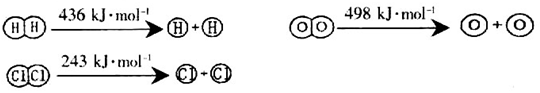
①H2與O2反應生成氣態水的熱化學方程式為_________________________________;
②斷開1mol H—O鍵所需能量約為_________________________kJ。
(2)已知某反應的平衡常數表達式為:K= ,它所對應的化學方程式為________________。
,它所對應的化學方程式為________________。
(3)已知反應N2(g)+3H2(g) 2NH3(g) △H<0在400℃時K=0.5,此條件下在0.5L的密閉容器中進行該反應,一段時間后,測得N2、H2、NH3的物質的量分別為2mol、1mol、2mol,則此時反應υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得該反應的化學反應速率加快,同時使平衡時NH3的體積百分數增加,可采取的措施是_______(填序號)。
2NH3(g) △H<0在400℃時K=0.5,此條件下在0.5L的密閉容器中進行該反應,一段時間后,測得N2、H2、NH3的物質的量分別為2mol、1mol、2mol,則此時反應υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得該反應的化學反應速率加快,同時使平衡時NH3的體積百分數增加,可采取的措施是_______(填序號)。
A.縮小體積增大壓強 B.升高溫度
C.加催化劑 D.使氨氣液化移走
(4)在一定體積的密閉容器中進行如下化學反應:A(g)+3B(g) 2C(g)+D(s) △H,其化學平衡常數K與T的關系如下表:
2C(g)+D(s) △H,其化學平衡常數K與T的關系如下表:
| T/K | 300 | 400 | 500 | …… |
| K/(mol·L-1)2 | 4×106 | 8×107 | 1.2×109 | …… |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com