
【題目】下列解釋事實的離子方程式中,不正確的是![]()
A.鋁片放入NaOH溶液中有氣體產生:![]()
B.泡沫滅火器滅火的原理:![]()
C.氨水吸收少量![]() 防止污染空氣:
防止污染空氣:![]()
D.“84”消毒液中滴少量白醋可增強漂白性:![]()
【答案】C
【解析】
A.鋁與氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣;
B.泡沫滅火器的滅火原理:鋁離子與碳酸根離子發生雙水解反應;
C.氨水與少量的二氧化硫反應生成亞硫酸銨;
D.醋酸的酸性大于次氯酸,醋酸能與次氯酸鹽反應生成次氯酸。
![]() 片置于NaOH溶液中,產生氣體,反應的離子方程式為:
片置于NaOH溶液中,產生氣體,反應的離子方程式為:![]() ,故A正確;
,故A正確;
B.泡沫滅火器的滅火原理:鋁離子與碳酸氫根離子發生雙水解反應,離子方程式為:![]() ,故B正確;
,故B正確;
C.氨水與少量的二氧化硫反應生成亞硫酸銨,沒有亞硫酸氫根離子生成,正確的離子方程式為:![]() ,故C錯誤;
,故C錯誤;
D.醋酸的酸性大于次氯酸,醋酸能與次氯酸鹽反應生成次氯酸,則“84”消毒液中滴少量白醋可增強漂白性:![]() ,故D正確;
,故D正確;
故選:C。


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源: 題型:
【題目】A、B是中學化學常見的化合物,它們各由兩種元素組成;乙為元素R組成的單質,它們之間存在如圖所示關系.根據要求回答問題:

![]() 如圖三個反應中,屬于氧化還原反應的有______個.
如圖三個反應中,屬于氧化還原反應的有______個.
![]() 若元素R與氧同主族,下列事實能說明R與氧的非金屬性相對強弱的有______.
若元素R與氧同主族,下列事實能說明R與氧的非金屬性相對強弱的有______.
A.還原性:![]() B.酸性:
B.酸性:![]()
C.穩定性:![]() C.沸點:
C.沸點:![]()
![]() 若化合物B常溫下為氣體,其水溶液呈堿性
若化合物B常溫下為氣體,其水溶液呈堿性![]() 答題必須用具體物質表示
答題必須用具體物質表示![]() .
.
![]() 化合物B的電子式為______;其水溶液呈堿性的原因是______
化合物B的電子式為______;其水溶液呈堿性的原因是______![]() 用離子方程式表示
用離子方程式表示![]() .
.
![]() 化合物B可與
化合物B可與![]() 組成燃料電池
組成燃料電池![]() 氫氧化鉀溶液為電解質溶液
氫氧化鉀溶液為電解質溶液![]() ,其反應產物與反應Ⅲ相同.寫出該電池負極的電極反應式______.
,其反應產物與反應Ⅲ相同.寫出該電池負極的電極反應式______.
![]() 當1mol的化合物B分別參與反應Ⅱ、Ⅲ時,熱效應為
當1mol的化合物B分別參與反應Ⅱ、Ⅲ時,熱效應為![]() 和
和![]() ,則反應Ⅰ的熱化學方程式為______
,則反應Ⅰ的熱化學方程式為______![]() 注:反應條件相同、所有物質均為氣體
注:反應條件相同、所有物質均為氣體![]() .
.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳及其化合物用途廣泛。某礦渣的主要成分是NiFe2O4(鐵酸鎳)、NiO、FeO、CaO、SiO2等,如下圖是從該礦渣中回收NiSO4的工藝路線:
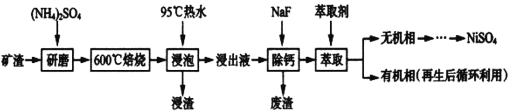
已知:(NH4)2SO4在350℃以上會分解生成NH3和H2SO4,NiFe2O4在焙燒過程中生成NiSO4、Fe2(SO4)3。錫(Sn)位于第五周期第IVA族。
(1)焙燒前將礦渣與(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”過程中Fe2(SO4)3生成FeO(OH)的離子方程式為_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外還含有___________________(填化學式)。
(3)為保證產品純度,要檢測“浸出液”的總鐵量:取一定體積的浸出液,用鹽酸酸化后,加入SnCl2將:Fe3+還原為Fe2+,所需SnC12的物質的量不少于Fe3+物質的量的_____倍:除去過量的SnCl2后,再用酸性K2Cr2O7標準溶液滴定溶液中的Fe2+,還原產物為Cr3+,滴定時反應的離子方程式為_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,當除鈣率達到99%時,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作該工藝的萃取劑。用電化學制備正十二烷的方法為:向燒杯中加入50mL甲醇,不斷攪拌加入少量金屬鈉,再加入11mL正庚酸攪拌均勻,裝好鉑電極,接通電源反應,當電流明顯減小時切斷電源,然后提純正十二烷。已知電解總反應為:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,則陽極的電極反應式為______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,則陽極的電極反應式為______________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.標準狀況下,11.2LSO3含有的氧原子個數為1.5NA
B.100g34%的雙氧水中含有H—O鍵的數目為2NA
C.16.25gFeCl3水解形成的Fe(OH)3膠體粒子數為0.1NA
D.16.8gFe粉與足量水蒸氣完全反應,轉移的電子數目為0.8NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋實驗事實的方程式不正確的是( )
A.用Na2S處理含Hg2+的廢水:Hg2++S2-=HgS↓
B.向沸水中滴加飽和氯化鐵溶液得到紅褐色液體:FeCl3+3H2O=Fe(OH)3(膠體)+3HCl
C.向Mg(OH)2懸濁液中滴加足量FeCl3溶液出現紅褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
D.Na2O2加入H218O中:2Na2O2+2H2l8O=4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某酸式鹽NaHY的水溶液顯堿性,下列敘述不正確的是
A.H2Y的電離方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的離子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.該酸式鹽溶液中離子濃度大小關系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.該酸式鹽溶液中微粒濃度關系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將28.8g銅與150mL一定濃度的硝酸反應,銅完全溶解,產生的NO和NO2混合氣體在標準狀況下的體積為11.2L。請回答:
(1)NO的體積為___L,NO2的體積為___L;
(2)待產生的氣體全部釋放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為___mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回收和利用CO2是環境科學家研究的熱點,是減輕溫室效應危害的重要途徑。
(1)在太陽能的作用下,以CO2為原料制取炭黑的流程如圖所示。其總反應的化學方程式為_____________。
(2)CO2經過催化氫化合成低碳烯烴。合成乙烯的反應為
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
鍵 | H-H | C=O | C=C | O-H | C-H |
鍵能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
則a=________。
(3)T℃時。在恒容密閉容器中充入1molCO2和nmolH2,在一定條件下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,混合氣體中CH3OH 的體積分數與氫氣的物質的量的關系如圖所示。圖1中A、B、C 三點對應的體系。CO的轉化率最大的是____(填字母),判斷理由是____________。
CH3OH(g)+H2O(g) △H<0,混合氣體中CH3OH 的體積分數與氫氣的物質的量的關系如圖所示。圖1中A、B、C 三點對應的體系。CO的轉化率最大的是____(填字母),判斷理由是____________。


(4) 工業上也用合成氣(H2和CO) 合成甲醇,反應為2H2(g)+CO(g)![]() CH3OH(g) △H<0,在10L的恒容密團容器中充入H2和CO的物質的量分別為2mol和1mol,測得CO的平衡轉化率與溫度、壓強的關系如圖2所示。
CH3OH(g) △H<0,在10L的恒容密團容器中充入H2和CO的物質的量分別為2mol和1mol,測得CO的平衡轉化率與溫度、壓強的關系如圖2所示。
①圖2中S代表的物理量是_________。
②已知300℃時上述反應達到平衡時,CO 的平衡轉化率為60% 若再向該平衡體系中再加入2molCO、2molH2、2molCH3OH 若保持溫度和容器休積不變,則平衡會_____(填“正向移動”“逆向移動”或“不移動”)。
(5)工業上常用高濃度的K2CO3溶液吸收CO2,得溶液X,再利用電解法使K2CO3溶液再生,其裝置示意圖如下圖所示:

①陽極區產生CO2的原因是________(用離子方程式表示)。
②利用平衡移動原理,簡述CO32-在陰極區再生的原因____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向Na2CO3溶液中滴加鹽酸,反應過程中能量變化如下圖所示,下列說法正確的是( )
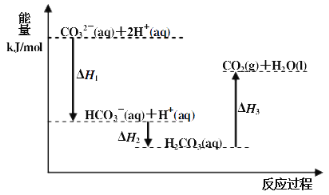
A.反應HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 為放熱反應
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
C.H1>H2 H2<H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化劑,則H3變小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com