
【題目】在2Mg+O2![]() 2MgO的化學反應中:
2MgO的化學反應中:
(1)氧元素的化合價由0價降低為________價,降低了________價;氧氣得到電子的總數為________。
(2)鎂原子失去電子的總數為________,1 mol Mg反應時轉移電子的物質的量為________。
科目:高中化學 來源: 題型:
【題目】CuCl為白色粉末,微溶于水,溶于濃鹽酸或NaCl濃溶液,不溶于乙醇。一種由海綿銅(Cu和少量CuO等)為原料制備CuCl的工藝流程如下:
(1)“溶解浸取”時,下列措施不能提高銅的浸取率的是__________(填序號)。
a.將海綿銅粉末與水攪拌成漿液 b.投料時,NaNO3適當過量
c.縮短浸取時間 d.將濾渣1返回再次溶解浸取
(2)“還原,氯化”時,Na2SO3和NaCl的用量對CuCl產率的影響如圖-1、圖-2所示:
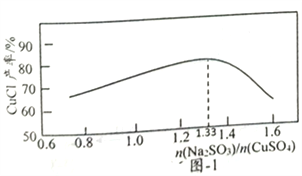

①CuSO4與Na2SO3、NaCl在溶液中反應生成CuCl的離了方程式為__________。
②當n(Na2SO3)/n(CuSO4)>1.33時,比值越大CuCl產率越小,其原因是__________。
③當1.0<n(NaCl)/n(CuSO4)<1.5時,比值越大CuCl產率越大,其原因是__________。
(3)“過濾2”所得濾液中溶質的主要成分為__________(填化學式)。
(4)用“醇洗”可快速去除濾渣表面的水,防止濾渣被空氣氧化為Cu2(OH)3Cl。CuCl被氧化為Cu2(OH)3Cl的化學方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】軟錳礦主要含有MnO2(約70%)、SiO2、Al2O3,閃鋅礦主要含有ZnS(約80%)、FeS、CuS、SiO2。為了高效利用這兩種礦石,科研人員開發了綜合利用這兩種資源的同槽酸浸工藝,主要流程如下圖所示,回答下列問題:
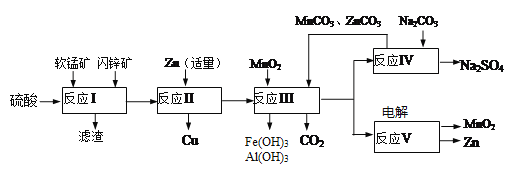
(1)反應Ⅰ所得濾液中含有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金屬陰離子,所得濾液中含有S和______。為了提高硫酸“酸浸”時的浸出速率,可進行的操作是(至少兩條):_________。
(2)若反成Ⅱ加入的鋅過量,還會進一步發生反應的離子方程式方為_________。
(3)反應Ⅲ中加入MnO2的作用是(離子方程式表示)________;反應Ⅲ中加入MnCO3、ZnCO3的作用是________________。
(4)反應Ⅴ的電解總反應為:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4,寫出陽極的電極反應式________________。
MnO2+Zn+2H2SO4,寫出陽極的電極反應式________________。
(5)MnO2和Zn可按等物質的量之比生產鋅-錳干電池,則從生產MnO2和Zn的角度計算,所用軟錳礦和閃鏟礦的質量比大約是______。(保留小數點后兩位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某強酸性溶液X中僅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一種或幾種,取該溶液進行連續實驗,實驗過程如下
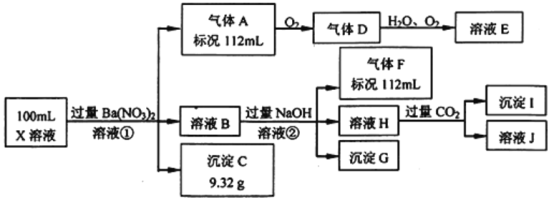
根據以上信息,回答下列問題:
(1)僅根據上述連續實驗不能確定溶液X中是否含有的離子分別是________。
(2)若②中所用氫氧化鈉濃度為2 mol/L,當加入10 mL時開始產生沉淀,55 mL時沉淀的量達到最大值0.03 mol,繼續滴加沉淀的量保持不變,隨后再滴加沉淀部分溶解,到60 mL時沉淀的量降為0.025 mol且保持不變,則原溶液中:c(Fe2+)為_____mol/L、c(Fe3+)為______mol/L、c(Cl-)為_____mol/L。(若有些離子不存在,請填0 mol/L)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在t ℃時,向x g KNO3不飽和溶液中加入a g KNO3或蒸發掉b g水,恢復到t ℃,溶液均達到飽和,據此,下列推論不正確的是( )
A. 在t ℃時,KNO3的溶解度為![]() g
g
B. 若原溶液中溶質的質量分數為![]() ,則x=2b
,則x=2b
C. 在t ℃時,所配的KNO3溶液中溶質的質量分數為w≤![]() %
%
D. 若將原溶液蒸發掉2b g水,恢復到原溫度析出2a g KNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應是一類重要的反應,在工農業生產、日常生活中都有廣泛的用途。
(1)火藥是中國的“四大發明”之一,永遠值得炎黃子孫驕傲。黑火藥在發生爆炸時,發生如下反應:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,還原產物是____________。
(2)實驗室為監測空氣中汞蒸氣的含量,往往懸掛涂有CuI的濾紙,根據濾紙是否變色或顏色發生變化所用去的時間來判斷空氣中的含汞量,其反應為4CuI+Hg=Cu2HgI4+2Cu。
①上述反應產物Cu2HgI4中,Cu元素顯________價。
②以上反應中的氧化劑為________,當有1 mol CuI參與反應時,轉移電子________mol。
③標明上述反應電子轉移的方向和數目______________________________。
(3)工業上常用酸性高錳酸鉀溶液處理含有CuS和Cu2S的礦物,其反應原理如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根據上述反應原理,某學習小組用400 mL 0.075 mol·L-1的酸性高錳酸鉀溶液處理2 g含有CuS和Cu2S的混合物。反應后煮沸溶液,趕盡SO2,剩余的KMnO4恰好與350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反應。
①配平KMnO4與(NH4)2Fe(SO4)2反應的離子方程式:
______MnO4-+______Fe2++______H+=______Mn2++______Fe3++______H2O。
②KMnO4溶液與固體混合物反應后,剩余KMnO4的物質的量為________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式為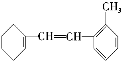
據此填寫下列空格。
(1)該物質苯環上一氯代物有________種;
(2)1 mol該物質和溴水混合,消耗Br2的物質的量為________mol;
(3)1 mol該物質和H2加成需H2________mol;
(4)下列說法不正確的是________。
A.該物質可發生加成、取代、氧化等反應
B.該物質與甲苯屬于同系物
C.該物質使溴水褪色的原理與乙烯相同
D.該物質使酸性KMnO4溶液褪色發生的是加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下面的方案進行某些離子的檢驗,其中方案設計嚴密的是
A. 檢驗試液中的SO42-![]()
B. 檢驗試液中的Fe2+![]()
C. 檢驗試液中的I-![]()
D. 檢驗試液中的CO32-![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-11。某溶液中含有Cl-,Br-,CrO42-,濃度均為0.010mol/L,向該溶液中逐滴加入0.010mol/L的AgNO3溶液時,三種陰離子產生沉淀的先后順序為
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-、
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com