
【題目】科學家對一碳化學進行了廣泛深入的研究并取得了一些重要成果。
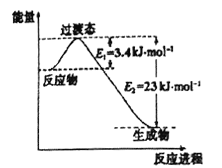
(1)目前工業上有一種方法是用CO2和H2在230℃催化劑條件下轉化生成甲醇蒸汽和水蒸氣。下圖表示恒壓容器中0.5molCO2和1.5molH2轉化率達80%時的能量變化示意圖。寫出該反應的熱化學方程式:__________________。
(2)現向三個體積均為2L的恒容密閉容器Ⅰ、Ⅱ、Ⅲ中均分別充入lmolCO和2molH2發生反應:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三個容器的反應溫度分別為T1、T2、T3且恒定不變,當反應均進行到5min時H2的體積分數如圖所示,其中只有一個容器中的反應己經達到平衡狀態.
CH3OH(g) △H1=-90.1kJ/mol。三個容器的反應溫度分別為T1、T2、T3且恒定不變,當反應均進行到5min時H2的體積分數如圖所示,其中只有一個容器中的反應己經達到平衡狀態.

① 三個容器中一定達到平衡狀態的是容器_____(填序號,下同)
②0~5min時間內容器I中用CH3OH表示的化學反應速率為__________。
③ 當三個容器中的反應均達到平衡狀態時CO 的轉化率最高的是容器_____;平衡常數最小的是容器______。
(3)CO常用于工業冶煉金屬.右下圖是在不同溫度下CO還原四種金屬氧化物達平衡后氣體中lg[![]() ]與溫度(t)的關系曲線圖。下列說法正確的是_______。
]與溫度(t)的關系曲線圖。下列說法正確的是_______。
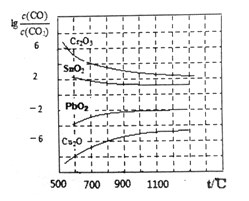
A.工業上可以通過增高反應裝置來延長礦石和CO接觸的時間,減少尾氣中CO的含量
B.CO不適宜用于工業冶煉金屬鉻(Cr)
C.工業冶煉金屬銅(Cu)時較低的溫度有利于提高CO的利用率
D.CO還原PbO2的反應△H>O
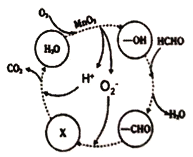
(4)某工廠工業廢水中含有甲醛,該廠降解甲醛的反應機理如圖所示,則X表示的粒子是____,總反應的化學方程式為_________。
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49kJ/mol Ⅲ 0.067 mol/(L·min) I Ⅲ BC( HCO3- ,HCHO+O2
CH3OH(g)+H2O(g) △H=-49kJ/mol Ⅲ 0.067 mol/(L·min) I Ⅲ BC( HCO3- ,HCHO+O2![]() CO2+H2O
CO2+H2O
【解析】(1)由恒壓容器中0.5molCO2和1.5molH2轉化率達80%時的能量變化示意圖可知,0.5molCO2和1.5molH2轉化率達80%時的能量變化為3.4kJ/mol-23kJ/mol=19.6kJ/mol,由此求出1molCO2和3molH2轉化率達100%時的能量變化為49kJ/mol,所以該反應的熱化學方程式為CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49kJ/mol。
CH3OH(g)+H2O(g) △H=-49kJ/mol。
(2)由圖像可知,T3>T2>T1,所以反應前5min的平均速率為III>II>I,從速率方面講,最先到達平衡狀態的一定是III,由于該反應△H1<0為放熱反應,該反應的化學平衡常數隨溫度升高而減小,所以從反應限度方面講,最先到達平衡狀態的也一定是III。
① 三個容器中一定達到平衡狀態的是容器III。
②設0~5min時間內容器I中CO(g)+2H2(g)![]() CH3OH(g)氫氣的轉化率為x
CH3OH(g)氫氣的轉化率為x
起始量(mol) 1 2 0
變化量(mol) x 2![]() x
x
5min量(mol) 1- x 2-2x x
由氫氣的體積分數為0.4=![]() ,解之得x=0.67,則用CH3OH表示的化學反應速率為
,解之得x=0.67,則用CH3OH表示的化學反應速率為![]() =0.067 mol/(L·min) 。
=0.067 mol/(L·min) 。
③ 當三個容器中的反應均達到平衡狀態時,KI>KII>KIII,CO 的轉化率最高的是容器I;平衡常數最小的是容器III。
(3)在平衡體系中,lg[![]() ]的值越小,說明反應的CO的轉化率越高,金屬氧化物越容易被還原,反之則越低,金屬氧化物越難被還原。由達平衡后氣體中lg[
]的值越小,說明反應的CO的轉化率越高,金屬氧化物越容易被還原,反之則越低,金屬氧化物越難被還原。由達平衡后氣體中lg[![]() ]與溫度(t)的關系曲線圖可知:A.工業上可以通過增高反應裝置來延長礦石和CO接觸的時間,減少尾氣中CO的含量,這個說法不正確,在平衡狀態下,CO的百分含量是保持不變的;B.由圖可知,即使在1300℃,lg[
]與溫度(t)的關系曲線圖可知:A.工業上可以通過增高反應裝置來延長礦石和CO接觸的時間,減少尾氣中CO的含量,這個說法不正確,在平衡狀態下,CO的百分含量是保持不變的;B.由圖可知,即使在1300℃,lg[![]() ]>2,
]>2, ![]() >102,則Cr2O3(s)+3CO(g)
>102,則Cr2O3(s)+3CO(g)![]() 2Cr(s)+3CO2(g),K=
2Cr(s)+3CO2(g),K=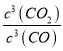 <10-6,所以CO不適宜用于工業冶煉金屬鉻(Cr)是正確的;C.由圖可知,在較低的溫度下,lg[
<10-6,所以CO不適宜用于工業冶煉金屬鉻(Cr)是正確的;C.由圖可知,在較低的溫度下,lg[![]() ]的值較小,所以工業冶煉金屬銅(Cu)時較低的溫度有利于提高CO的利用率是正確的;D.由圖像可知,CO還原PbO2的反應中lg[
]的值較小,所以工業冶煉金屬銅(Cu)時較低的溫度有利于提高CO的利用率是正確的;D.由圖像可知,CO還原PbO2的反應中lg[![]() ]的值隨溫度升高而增大,說明該反應的化學平衡常數隨溫度升高而減小,所以該反應為放熱反應,△H<O ,D不正確。綜上所述BC正確。
]的值隨溫度升高而增大,說明該反應的化學平衡常數隨溫度升高而減小,所以該反應為放熱反應,△H<O ,D不正確。綜上所述BC正確。
(4)由圖可知,-CHO與O2-反應后生成X,而X與H+反應生成的是CO2,所以X表示的粒子是HCO3-,總反應的化學方程式為,HCHO+O2![]() CO2+H2O。
CO2+H2O。


科目:高中化學 來源: 題型:
【題目】丙烯酸的結構簡式為CH2=CH—COOH,對其性質的描述不正確的是( )
A.能與金屬鈉反應放出氫氣B.能與新制氫氧化銅反應
C.能發生加聚反應生成高分子化合物D.能與溴水發生取代反應而使溴水褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,已知兩瓶容積相同,同溫同壓下,左瓶內充滿氯化氫氣體,當右瓶中充滿下列混合氣體中的某一組時,其所含原子總數與左瓶中所含原子總數一定相等,則該混合氣體是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】五種短周期元素的部分性質數據如下:
元素 | T | X | Y | Z | W |
原子半徑(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合價 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
請回答下列問題:
(1)Z離子的結構示意圖為________________。
(2)關于Y、Z兩種元素,下列敘述正確的是________(填序號)
a.簡單離子的半徑Y>Z
b.氣態氫化物的穩定性Y比Z強
c.最高價氧化物對應水化物的酸性Z比Y強
(3)甲是由T、X兩種元素形成的10e-分子,乙是由Y、W兩種元素形成的化合物。
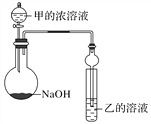
某同學設計了如圖所示裝置(夾持儀器省略)進行實驗,將甲的濃溶液逐滴加入到NaOH固體中,燒瓶中立即有甲放出,原因是______________________。
一段時間后,觀察到試管中的現象是______________________________,發生反應的離子方程式是______________________________________________。
(4)XO2是導致光化學煙霧的“罪魁禍首”之一。它被NaOH溶液吸收的化學方程式是:2XO2+2NaOH===M+NaXO3+H2O(已配平),產物M中元素X的化合價為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下列填空
(1)決定物質體積的因素有 ①構成物質的粒子數;②粒子大小;③粒子間的距離。對固體、液體物質而言,它主要是由上述______決定(填寫編號,下同);對氣體物質而言,它主要由上述_____決定。
(2)標準狀況下,體積為11.2 L 的CO2的 質量______g,其所含原子的總數是______ 個。
(3)配制100 mL2 molL-1的H2SO4溶液,需要某98%H2SO4溶液(密度為1.8g/cm-3)的體積為________ml(保留三位有效數字)。取配制后的溶液20ml,SO42-的物質的量為______,加入足量的鋅,生成標況下氫氣的體積為:______ L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化鐵溶液與氫氧化鐵膠體具有的共同性質是 ( )
A. 分散質粒子大小都在1~100nm之間 B. 都有丁達爾效應
C. 分散質粒子都能通過濾紙 D. 都呈紅褐色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗方法正確的是是( )
A.用水鑒別四氯化碳、苯和乙醇
B.除去乙烷中少量的乙烯:通過酸性高錳酸鉀溶液洗氣
C.除去苯中少量的苯酚:加足量NaOH溶液,蒸餾
D.用碘水檢驗淀粉是否已經開始水解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】月球上有頗為豐富的核聚變燃料He。有關He的說法正確的是( )
A. 原子序數為3 B. 中子數為3
C. 與He互為同位素 D. 核外電子數為3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com