
【題目】A、B、C三種物質中均含有同一種元素,它們之間存在如圖所示的轉化關系(部分反應物已略去). 
請回答下列問題:
(1)若A是一種金屬氧化物,B、C均為正鹽且B的水溶液呈酸性,C的水溶液呈堿性.請寫出反應①和反應④(A可一步轉化為B或C)的離子方程式:反應① , 反應④
(2)若反應①為置換反應,反應④為化合反應,C物質大量存在于海水中,是人體生理活動不可缺少的物質.工業上可以用C來制取A或B,請寫出這兩個反應的化學方程式:C→A;C→B .
(3)若反應①②③均為化合反應,反應④為置換反應.當A為一種金屬單質時,請寫出反應②和③可能的離子方程式:反應②:;反應③: .
【答案】
(1)Al2O3+6H+=2Al3++3H2O;Al2O3+2OH﹣=2AlO2﹣+H2O
(2)2NaCl(熔融) ![]() 2Na+Cl2↑;2NaCl+2H2O
2Na+Cl2↑;2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)2Fe3++Fe=3Fe2+;2Fe2++Cl2=2Fe3++2Cl﹣(或2Fe2++Br2=2Fe3++2Br﹣)
【解析】解:(1)金屬氧化物對應的正鹽B、C的水溶液分別呈酸性、堿性,高中化學只有兩性氧化物才具有這樣的特征,可聯想到兩性氧化物Al2O3 , 則B含有Al3+ , C含有AlO2﹣ , 則反應①為Al2O3+6H+=2Al3++3H2O,反應④為Al2O3+2OH﹣=2AlO2﹣+H2O,
所以答案是:Al2O3+6H+=2Al3++3H2O; Al2O3+2OH﹣=2AlO2﹣+H2O;(2)C物質大量存在于海水中,是人體生理活動不可缺少的物質,應為NaCl,工業上可以用C來制取A或B,則A為Na,B為NaOH,
C→A,可用電解熔融的NaCl反應制備,方程式為2NaCl(熔融) ![]() 2Na+Cl2↑,C→B,可用電解飽和食鹽水制備,反應為2NaCl+2H2O
2Na+Cl2↑,C→B,可用電解飽和食鹽水制備,反應為2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
所以答案是:2NaCl(熔融) ![]() 2Na+Cl2↑; 2NaCl+2H2O
2Na+Cl2↑; 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(3)金屬單質連續發生化合反應,容易聯想到連續氧化,猜測A為變價金屬鐵,鐵與氯氣反應得到氯化鐵,氯化鐵與鐵反應得到氯化亞鐵,氯化亞鐵與氯氣反應得到氯化鐵,鐵與鹽酸發生置換反應可以得到氯化亞鐵,也可以是鐵與溴的反應,反應②為2Fe3++Fe=3Fe2+ , 反應③為2Fe2++Cl2=2Fe3++2Cl﹣(或2Fe2++Br2=2Fe3++2Br﹣),
2NaOH+H2↑+Cl2↑;(3)金屬單質連續發生化合反應,容易聯想到連續氧化,猜測A為變價金屬鐵,鐵與氯氣反應得到氯化鐵,氯化鐵與鐵反應得到氯化亞鐵,氯化亞鐵與氯氣反應得到氯化鐵,鐵與鹽酸發生置換反應可以得到氯化亞鐵,也可以是鐵與溴的反應,反應②為2Fe3++Fe=3Fe2+ , 反應③為2Fe2++Cl2=2Fe3++2Cl﹣(或2Fe2++Br2=2Fe3++2Br﹣),
所以答案是:2Fe3++Fe=3Fe2+;2Fe2++Cl2=2Fe3++2Cl﹣(或2Fe2++Br2=2Fe3++2Br﹣).


 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.在原電池的負極和電解池的陰極上都發生失電子的氧化反應
B.用惰性電極電解Na2SO4溶液,陰陽兩極產物的物質的量之比為1:2
C.用惰性電極電解飽和NaCl溶液,若有0.1 mol電子轉移,則生成0.1 mol NaOH
D.鍍層破損后,鍍鋅鐵板比鍍錫鐵板更易腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水開發利用的部分過程如圖所示.下列說法錯誤的是( ) 
A.向苦鹵中通入Cl2是為了提取溴
B.粗鹽可采用除雜和重結晶等過程提純
C.工業生產常選用NaOH作為沉淀劑
D.富集溴一般先用空氣和水蒸氣吹出單質溴,再用SO2將其還原吸收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知如表數據:
化學式 | 電離平衡常數(25℃) |
HCN | K=5.0×10﹣10 |
H2CO3 | K1=4.4×10﹣7 , K2=4.7×10﹣11 |
向NaCN溶液中通入少量CO2 , 所發生反應的化學方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用銅片、銀片、Cu(NO3)2溶液、AgNO3溶液、導線和鹽橋(裝有瓊脂﹣KNO3的U形管)構成一個原電池(如圖).以下有關該原電池的敘述正確的是
①在外電路中,電子由銅電極流向銀電極
②正極反應為:Ag++e﹣=Ag
③實驗過程中取出鹽橋,原電池仍繼續工作
④將銅片浸入AgNO3溶液中發生的化學反應與該原電池反應相同( )
A.①②
B.①②④
C.②③
D.①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知4NH3+5O2═4NO+6H2O(g),若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則正確的關系是( )
A.![]() ?v(NH3)=v(O2)
?v(NH3)=v(O2)
B.![]() ?v(O2)=v(H2O)
?v(O2)=v(H2O)
C.![]() ?v(NH3)=v(H2O)
?v(NH3)=v(H2O)
D.![]() ?v(O2)=v(NO)
?v(O2)=v(NO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應2CO(g)=2C(s)+O2(g)的△H為正值,△S為負值.設△H和△S不隨溫度改變,下列說法中正確的是( )
A.低溫下能自發進行
B.高溫下能自發進行
C.低溫下不能自發進行,高溫下能自發進行
D.任何溫度下都不能自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉硫電池作為一種新型儲能電池,其應用逐漸得到重視和發展.
(1)Al(NO3)3是制備鈉硫電池部件的原料之一.由于Al(NO3)3容易吸收環境中的水分,因此需要對其進行定量分析.具體步驟如圖所示: 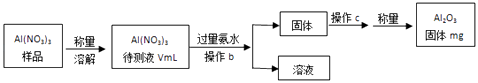
①加入過量氨水后發生反應的離子方程式為: .
②操作b為:
③Al(NO3)3待測液中,c(Al3+)=mol/L(用含m、V的代數式表示).
(2)鈉硫電池以熔融金屬鈉、熔融硫和多硫化鈉(Na2SX)分別作為兩個電極的反應物,固體Al2O3陶瓷(可傳導Na+)為電解質,其反應原理如圖1所示: 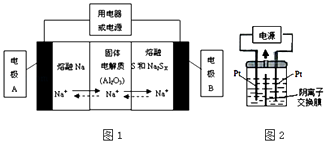
物質 | Na | S | Al2O3 |
熔點/℃ | 97.8 | 115 | 2050、 |
沸點/℃ | 892 | 444.6 | 2980 |
①根據表數據,請你判斷該電池工作的適宜應控制在(填字母)范圍內.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放電時,電極A為極,電極B發生反應(填“氧化或還原”)
③充電時,總反應為Na2SX═2Na+xS(3<x<5),則陽極的電極反應式為: .
(3)若把鈉硫電池作為電源,電解槽內裝有KI及淀粉溶液如圖2所示,槽內的中間用陰離子交換膜隔開.通電一段時間后,發現左側溶液變藍色,一段時間后,藍色逐漸變淺.則右側發生的電極方程式:;試分析左側溶液藍色逐漸變淺的可能原因是: .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com