
【題目】氧化鐵的用途較為廣泛。工業上用廢鐵屑制備氧化鐵的流程如圖:
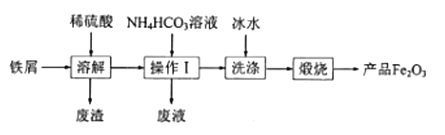
(1)“溶解”時主要反應的離子方程式為___。
(2)操作Ⅰ的名稱是___。
(3)加入 NH4HCO3溶液生成FeCO3沉淀和CO2,則“廢液”中含有的主要離子有___。
(4)在空氣中煅燒FeCO3可得產品Fe2O3,寫出該反應的化學方程式:___。實際生產時,產品Fe2O3中常混有FeO。為了減少FeO,“煅燒”時可以采取的措施有___(寫一條)。
(5)產品Fe2O3與A粉的混合物稱為鋁熱劑,可用于焊接鐵軌。該反應的化學方程式為___。
【答案】Fe+2H+=Fe2++H2↑ 過濾 NH4+、SO42- 4FeCO3+O2![]() 2Fe2O3+4CO2 通入足量的空氣或延長煅燒時間 2Al+Fe2O3
2Fe2O3+4CO2 通入足量的空氣或延長煅燒時間 2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
【解析】
Fe和稀硫酸反應生成FeSO4和H2,FeSO4和NH4HCO3反應生成FeCO3、CO2和(NH4)2SO4,FeCO3在空氣中煅燒生成Fe2O3。
⑴“溶解”為Fe和稀硫酸反應生成FeSO4和H2,其離子方程式Fe+2H+ =Fe2++H2↑;
⑵FeSO4和NH4HCO3反應生成FeCO3沉淀,因此操作Ⅰ的名稱是過濾;
⑶加入NH4HCO3溶液是FeSO4和NH4HCO3反應生成FeCO3沉淀、(NH4)2SO4和CO2,則“廢液”中含有的主要離子有NH4+、SO42-;
⑷在空氣中煅燒FeCO3可得產品Fe2O3,化合價由升降,說明有氧氣參與反應,因此反應的化學方程式:4FeCO3+O2![]() 2Fe2O3+4CO2,實際生產時,產品Fe2O3中常混有FeO,為了減少FeO,“煅燒”時可以采取的措施有通入足量的空氣或延長煅燒時間;
2Fe2O3+4CO2,實際生產時,產品Fe2O3中常混有FeO,為了減少FeO,“煅燒”時可以采取的措施有通入足量的空氣或延長煅燒時間;
⑸產品Fe2O3與A粉的混合物稱為鋁熱劑,可用于焊接鐵軌。該反應的化學方程式為2Al+Fe2O3![]() Al2O3+2Fe。
Al2O3+2Fe。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:
【題目】某化學探究小組擬用銅片制取Cu(NO3) 2,并探究其化學性質。
I.他們先把銅粉放在空氣中灼燒,再與稀HNO3反應制取硝酸銅。
(1)如果直接用銅屑與稀HNO3反應來制取硝酸銅,可能導致的兩個不利因素是______。
(2)實驗中銅粉應該放在_____(選填“蒸發皿”、“坩堝”或“燒杯”)中灼燒。欲從反應后的溶液中得到硝酸銅晶體,實驗操作步驟按順序分別是___、____、過濾。
II.為了探究Cu(NO3)2的熱穩定性,探究小組按下圖中的裝置進行實驗。(圖中鐵架臺、鐵夾和加熱設備均略去)
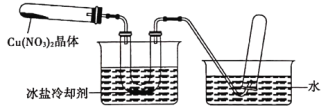
往左試管中放入研細的無水Cu(NO3)2晶體并加熱,觀察到左試管中有紅棕色氣體生成,最終殘留黑色粉末;用U型管除去紅棕色氣體,在右試管中收集到無色氣體。
(1)紅棕色氣體是____。
(2)當導管口不再有氣泡冒出時,停止反應,這時在操作上應注意________。
(3)探究小組判斷Cu(NO3)2的分解屬于氧化還原反應,產物除了紅棕色氣休和黑色固體外,進一步分析、推斷,分解產物中一定還含有_____。
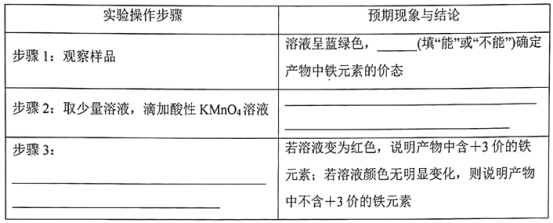
III.為了探究Cu(NO3)2在酸性條件下跟鐵單質的反應。他們取一支試管,加入Cu(NO3)2溶液,滴入適量稀硫酸酸化,再加入一定量鐵粉,實驗后沒有固體殘留物質。該探究小組對反應后溶液中鐵元素的價態進行探究,他們設計了實驗方案,并進行實驗。請在下面表格中補充寫出實驗操作步驟、預期現象與結論___、___、___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】漆酚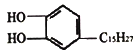 是生漆的主要成分,能溶于有機溶劑中,生漆涂在物體表面,能在空氣中干燥轉變為黑色漆膜從而起到保護層的作用,下列說法錯誤的是
是生漆的主要成分,能溶于有機溶劑中,生漆涂在物體表面,能在空氣中干燥轉變為黑色漆膜從而起到保護層的作用,下列說法錯誤的是
A. 可以燃燒,當氧氣充分時,產物為CO2和H2O
B. 與FeCl3溶液發生顯色反應
C. 能發生取代反應和加成反應
D. 不能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國擁有豐富的稀土礦產資源,在合金中加入適量的稀土金屬,能大大改善合金的性能,因而,稀土金屬又被稱為冶金工業的維生素。鈰是一種重要的稀土元素,常見的化合價為+3和+4。某課題小組以平板電視顯示屏生產過程中,產生的大量廢玻璃粉末為原料(其中含有SiO2、Fe2O3、CeO2、FeO等物質),制取CeO2和硫酸鐵銨礬[NH4Fe(SO4)212H2O],流程如下:
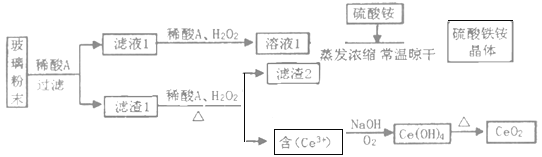
已知:CeO2不溶于強酸或強堿
(1)稀酸A中酸的分子式是___。濾渣2的主要成分___。(填化學式)
(2)濾液1中加入H2O2溶液的目的是___。濾渣1中加入H2O2,主要利用了H2O2的什么性質?___。
(3)酸性條件下,H2O2、Fe3+、CeO2三種物質,氧化性由強到弱的順序是___。
(4)寫出由濾液2生成Ce(OH)4的離子方程式___。
(5)硫酸鐵銨礬[NH4Fe(SO4)212H2O]廣泛用于水的凈化處理,其凈水原理是___(用離子方程式表示)。
(6)取上述流程中所獲得的Ce(OH)4樣品5.31g,加稀H2SO4溶解后配制成100mL溶液,取出10.00mL,用濃度為0.1000 molL-1FeSO4標準溶液滴定至終點時(鈰被還原為Ce3+),消耗25.00mL標準溶液。該樣品中Ce(OH)4的純度是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、氮是中學化學重要的非金屬元素,在生產、生活中有廣泛的應用。
(1)治理汽車尾氣中NO和CO的一種方法是:在汽車的排氣管道上安裝一個催化轉化裝置,使NO與CO反應,產物都是空氣中的主要成分。寫出該反應的熱化學方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用發生的反應如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
該反應達到化學平衡后,若改變下列條件,CO2轉化率增大的是___。
a.增大CO2的濃度 b.取走一半C6H12O6 c.加入催化劑 d.適當升高溫度
(3)N2O5的分解反應2N2O5(g)![]() 4NO2(g)+O2(g),由實驗測得在67℃時N2O5的濃度隨時間的變化如下:
4NO2(g)+O2(g),由實驗測得在67℃時N2O5的濃度隨時間的變化如下:
時間/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
計算在0~2min時段,化學反應速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以將CO2轉化為炭黑進行回收利用,反應原理如圖所示。
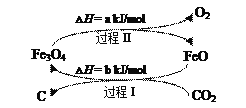
①在轉化過程中起催化作用的物質是___;
②寫出總反應的化學方程式___。
(5)工業上以NH3和CO2為原料合成尿素[CO(NH2)2),反應的化學方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)根據上述反應,填寫下列空白
CO(NH2)2(l)+H2O(l)根據上述反應,填寫下列空白
①己知該反應可以自發進行,則△H___0。(填“>”、“<”或“=”);
②一定溫度和壓強下,若原料氣中的NH3和CO2的物質的量之比![]() =x,如圖是x與CO2的平衡轉化率(α)的關系。α隨著x增大而增大的原因是___;B點處,NH3的平衡轉化率為___。
=x,如圖是x與CO2的平衡轉化率(α)的關系。α隨著x增大而增大的原因是___;B點處,NH3的平衡轉化率為___。
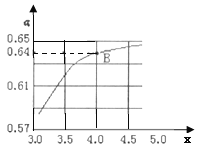
③一定溫度下,在3L定容密閉容器中充入NH3和CO2,若x=2,當反應后氣體壓強變為起始時氣體壓強的![]() 時達到平衡,測得此時生成尿素90g。該反應的平衡常數K=___。
時達到平衡,測得此時生成尿素90g。該反應的平衡常數K=___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】摩爾鹽是一種重要的化工原料,化學組成可表示為x(NH4)2SO4yFeSO4zH2O。
為確定摩爾鹽的組成,進行如下實驗:
步驟一:稱取一定量的新制摩爾鹽,溶于水配制成100.00mL溶液A。
步驟二:準確量取25.00mL溶液A,加入足量BaCl2溶液,充分反應后過濾、洗滌、干燥,得白色固體2.330g。
步驟三:另取25.00mL溶液A,加入0.05000molL-1KMnO4酸性溶液,發生反應:Fe2++MnO4-+H+→Fe3++Mn2++H2O(未配平),當兩者恰好完全反應時,消耗KMnO4溶液的體積為20.00mL。
(1)步驟一中,必須使用到的玻璃儀器有玻璃棒、膠頭滴管、燒杯和___。
(2)檢驗溶液A中含有NH4+的實驗方法是___。
(3)步驟二中,證明所加BaCl2溶液己經過量的實驗方法為___。
(4)通過計算確定摩爾鹽中x:y的值___(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() 、
、![]() 均為短周期元素,A元素的陽離子與B元素的陰離子具有相同的電子層結構,有關兩元素有以下敘述:①原子序數:A>B;②原子半徑:A<B;③離子半徑:A>B;④原子最外層電子數:A≤B,其中正確的是( )
均為短周期元素,A元素的陽離子與B元素的陰離子具有相同的電子層結構,有關兩元素有以下敘述:①原子序數:A>B;②原子半徑:A<B;③離子半徑:A>B;④原子最外層電子數:A≤B,其中正確的是( )
A.①②B.①④C.②③D.②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈷元素是三元鋰離子電池陽極材料的重要成分。請回答下列問題:
(1)鈷元素在周期表中的位置是___________,其外圍電子排布式為___________。
(2)已知第四電離能大小:I4(Fe)> I4 (Co),從原子結構的角度分析可能的原因是___________。
(3)配位化學創始人維爾納發現,取1mol配合物CoCl3·6NH3(黃色)溶于水,加人足量硝酸銀溶液,產生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中絡離子形狀為正八面體。
①根據上述事實推測原配合物中絡離子化學式為___________。
②該配合物在熱NaOH溶液中發生反應,并釋放出氣體,該反應的化學方程式___________;生成氣體分子的中心原子雜化方式為___________。
(4)經X射線衍射測定發現,晶體鈷在417℃以上堆積方式的剖面圖如圖所示,則該堆積方式屬于___________,若該堆積方式下的晶胞參數為acm,則鈷原子的半徑為___________pm。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知水在25℃和100℃時,其電離平衡曲線如圖所示:

①則25℃時水的電離平衡曲線應為_____。(填“A”或“B”)
②25℃下,下列三種溶液中,由水電離出的氫離子的物質的量濃度之比a:b:c=_____。
a.pH=1的鹽酸b.pH=2的鹽酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的鹽酸與VbLpH=b的NaOH溶液恰好中和,a+b=13,則Va:Vb=_____。
(2)某溫度(t℃)時,測得0.01mol·L-1的NaOH溶液的pH=13。
①該溫度下水的Kw=_____。
②此溫度下,將pH=1的鹽酸溶液VaL與pH=14的NaOH溶液VbL混合(忽略體積變化),混合后溶液的pH為2,則Va:Vb=_____。
(3)下列說法中正確的是_____。
a.25℃時,pH=12的氨水和pH=2的H2SO4溶液等體積混合,所得溶液pH>7
b.100℃時,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃時,由水電離出的氫離子濃度為1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com