
【題目】以硼鎂泥(主要成分為MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)為原料制備高純Mg(OH)2的流程如下:
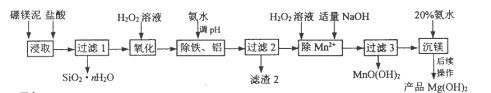
己知:
①常溫下此體系中各氫氧化物開始沉淀與沉淀完全時的pH范圍如下表所示:
pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
開始沉淀時 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
沉淀完全時 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
②溫度高于340℃時Mg(OH)2開始分解為MgO和H2O。
(1)“浸取”時,為提高鎂的浸取率可行的措施為__________。
a.將硼鎂泥制成漿料 b.降低浸取溫度 c.用鹽酸多次浸取
(2)“浸取”時,MgSiO3與鹽酸反應的化學方程式為_________________________。
(3)“除鐵、鋁”時,需調節(jié)溶液pH范圍為_________________________。
(4)“除Mn2+”時發(fā)生反應的離子方程式為_________________________;
過濾3所得濾渣中含有MnO(OH)2和__________。
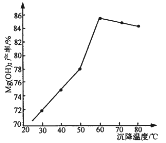
(5)“沉鎂”時,反應溫度與Mg(OH)2的產率如圖所示,當溫度超過60℃,隨溫度再升高,Mg(OH)2產率反而降低,其原因可能是________________。
【答案】 ac MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2·nH2O 4.7<pH<7.1 Mn2++H2O2+2OH-=MnO(OH)2↓+H2O Mg(OH)2 氨水揮發(fā)加劇,導致溶液中氨水濃度降低。
【解析】(1)此處主要考查反應速率的影響因素,所以要想加快酸溶解速率可以從外因濃度、溫度、接觸面積等考慮,可以采取升溫、把硼鎂泥粉碎、攪拌等措施,答案選ac。
(2)根據濾渣1可知:MgSiO3與鹽酸反應生成SiO2·nH2O,還有產物MgCl2、H2O方程式為MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2·nH2O
(3)加入雙氧水后,Fe2+轉化為Fe3+,要使Fe3+、Al3+完全沉淀,pH必須大于或等于4.7,Mn2+不沉淀,pH小于或等于7.1,所以答案為4.7<pH<7.1
(4)Mn2+在堿性下被H2O2氧化生成MnO(OH)2,H2O2被還原為H2O,離子方程式為Mn2++H2O2+2OH-=MnO(OH)2↓+H2O 。MnO(OH)2沉淀完全時pH已達9.8,該條件下,Mg2+已經沉淀,故還有Mg(OH)2沉淀生成,故過濾3所得濾渣中含有MnO(OH)2和Mg(OH)2。
(5)溫度過高,氨水揮發(fā)加劇,溶液中氨水濃度減小,導致Mg(OH)2產率降低。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】(1)某溫度時,在一個2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示.根據圖中數據,回答下列問題:

①該反應在_________min時達到化學平衡狀態(tài)。
②該反應的化學方程式是______________________。
③從開始到2min,Z的平均反應速率是________________________。
(2)某原電池的裝置如圖所示,看到a極上有紅色金屬析出,回答下列問題:

①若a、b是兩種活動性不同的金屬,則活動性a____b(填>、<或=);
②電路中的電子從____經導線流向_____(填a或b);
③溶液中的SO42-向________極移動(填a或b);
④若兩電極分別是Al和C,則負極的電極反應式為_________________。
(3)將甲醇與氧氣分別通入如圖所示的裝置的電極中,可構成甲醇燃料電池,請回答下列問題:

通入甲醇的電極是_____(填“正”或“負”)極,反應時該電極附近的現象是_____________________________,溶液中K+向____(填“正”或“負”)極移動:寫出正極反應式:_______________;若電池工作過程中通過2mol電子,則理論上消耗O2__L(標準狀況)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用氯酸鉀與密度為1.19gcm﹣3,溶質質量分數為36.5%的濃鹽酸反應制取氯氣。
I.反應方程式如下:___KClO3+ HCl= KCl+ Cl2↑+ H2O
(1)配平方程式,并用雙線橋法表示上述反應中電子轉移的方向和數目。
(2)若反應中被氧化的鹽酸為5mol,則生成的氯氣體積為__________(標準狀況下)。
II.甲同學設計如圖所示裝置研究氯氣能否與水發(fā)生反應,氣體a是含有少量空氣和水蒸氣的氯氣。請回答下列問題:

(1)證明氯氣和水反應的實驗現象為__________,反應的化學方程式是__________。
(2)若將氯氣通入石灰乳制取漂白粉,反應的化學方程式是__________,漂白粉溶于水后,遇到空氣中的CO2,即產生漂白、殺菌作用,反應的化學方程式是__________。
III.乙同學用上述濃鹽酸配置0.100 mol·L-1的稀鹽酸480 mL,下列說法正確的是__________。
A.取用240 mL的容量瓶
B.應量取上述濃鹽酸的體積為4.2mL
C.定容搖勻后發(fā)現液面低于刻度線,再加蒸餾水與刻度線相切,所配溶液濃度偏小
D.定容時,仰視刻度線所配溶液濃度偏大
E.量取上述濃鹽酸的體積時俯視刻度線所配溶液濃度偏大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知拆開1mol氫氣中化學鍵需要吸收436kJ熱量,拆開1mol氧氣中的化學鍵需要吸收496kJ的熱量,形成1molH—O共價鍵放出463kJ的熱量。反應2H2(g)+O2(g)=2H2O(g)的能量變化如右圖所示。下列說法正確的是

A. 2H(g)→H2(g) ![]() H >0
H >0
B. 圖中E1 = 932kJ
C. 圖中E2 = 926 kJ
D. 2H2(g)+O2(g)=2H2O(g) ![]() H =-484 kJ·mol-1
H =-484 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳的捕捉、封存與再利用是實現溫室氣體減排的重要途徑之一。
(1)二氧化碳的電子式為___________。
(2)下列利用二氧化碳的反應中原子利用率達100%的是_________(填序號)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.![]()
(3)一種正在開發(fā)的利用二氧化碳制取甲醇的流程如下:
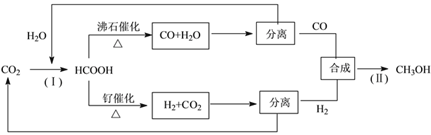
①反應(Ⅰ)將CO2和H2O轉化為甲酸常用途徑有兩種,如下圖(a)和(b)。
圖(a)中能量主要轉化方式為___________,圖(b)中發(fā)生反應的化學方程式為___________。
②在5L的恒溫恒容密閉容器中充入1moLCO和4molH2,加入催化劑發(fā)生反應,測得CO及CH3OH的物質的量隨時間變化如下圖所示。
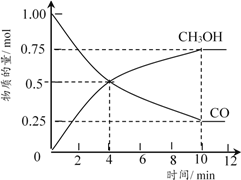
圖中第___________min(填數字)反應達到平衡,CO在0~4min內的平均反應速率比在4~8min內的快,其原因是___________;達到平衡時氫氣的濃度為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現象,與新制氯水中的某些成分(括號內物質)沒有關系的是( )
A.將NaHCO3固體加入新制氯水中,有無色氣泡(H+)
B.使紅色布條退色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,發(fā)現呈紅色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl﹣)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.砷(As)是第四周期VA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有著廣泛的用途。回答下列問題:
(1)畫出砷的原子結構示意圖______________。
(2)工業(yè)上常將含砷廢渣(主要成分為As2S3)制成漿狀,通入O2氧化,生成H3AsO4和單質硫。寫出發(fā)生反應的化學方程式________________________________。
(3)298K時,將20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,發(fā)生反應:![]() 。溶液中
。溶液中![]() 與反應時間(t)的關系如圖所示。
與反應時間(t)的關系如圖所示。
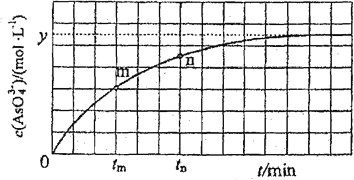
①下列可判斷反應達到平衡的是________(填標號)。
a.溶液的pH不再變化
b.v(I-)=2v(![]() )
)
C.![]() /
/![]() 不再變化
不再變化
d.c(I-)=2ymol·L-1
②tm時,V正________V逆(填“大于”“小于”或“等于”)。
③tm時V逆________tm時V逆(填“大于”“小于”或“等于”),理由是____________________________。
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(1)以CO或CO2與H2為原料,在一定條件下均可合成甲醇,你認為用哪種合成設計線路更符合“綠色化學”理念:(用化學反應方程式表示)________。
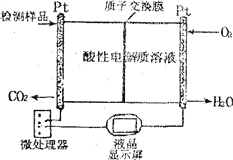
(2)如圖所示是用于合成甲醇產品中甲醇含量的檢測儀。
寫出該儀器工作時的總反應式及正極反應式:
總反應式__________________________
正極反應式__________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根據以上熱化學方程式判斷,下列說法正確的是( )
A. CO的燃燒熱為283 kJ
B. 下圖可表示由CO生成CO2的反應過程和能量關系
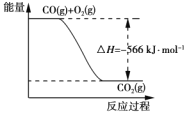
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)與Na2O2(s)反應放出509 kJ熱量時,電子轉移數為6.02×1023
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com