
 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源:2016-2017學年福建省高一上第一次月考化學卷(解析版) 題型:選擇題
查閱資料發現,金屬鈉不僅能跟氧氣和水反應,還能跟多種其他物質發生反應,其中包括與酒精在常溫下反應。要研究金屬鈉跟酒精反應的性質以及它與水反應的異同點,下列的研究方法中用不到的是
A.實驗法 B. 分類法 C. 觀察法 D.比較法
查看答案和解析>>
科目:高中化學 來源:2017屆山東省新泰市高三上學期第一次階段考化學試卷(解析版) 題型:選擇題
下列指定反應的離子方程式正確的是
A.將銅插入稀硝酸中:Cu+4H++2NO3 -=Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入過量鐵粉:Fe3++Fe=2Fe3+
C.向Al2(SO4)3溶液中加入過量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀鹽酸:Na2SiO3+2H+=H2SiO3↓+3Na+
查看答案和解析>>
科目:高中化學 來源:2017屆山東省高密市高三上學期10月統考化學試卷(解析版) 題型:選擇題
常溫下,關于pH=2的鹽酸,下列說法不正確的為
A.溶液中c(H+) = 1.0×10-2 mol·L-1
B.此溶液中由水電離出的c(OH-) = 1.0×10-12 mol·L-1
C.加水稀釋100倍后,溶液的pH = 4
D.加入等體積pH = 12的氨水,溶液呈中性
查看答案和解析>>
科目:高中化學 來源:2017屆山東省高密市高三上學期10月統考化學試卷(解析版) 題型:選擇題
三位科學家保羅·克拉茲等因在氟利昂和臭氧層方面的工作獲得諾貝爾化學獎,他們的研究揭示了大氣中臭氧層被破壞的機理,如下圖所示:

下列說法不正確的是( )
A.氯原子在反應中做催化劑 B.過氧化氯的結構式為:O—Cl—Cl—O
C.臭氧分子最終轉變成氧氣分子 D.過程②中一氧化氯斷鍵形成過氧化氯
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省高二上第一次月考化學試卷(解析版) 題型:實驗題
(1)用標準的鹽酸滴定待測的NaOH溶液時,左手握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視____________。直到因加入一滴鹽酸后,溶液由黃色變為橙色,并______________為止。
(2)下列操作中可能使所測NaOH溶液的濃度數值偏低的是( )
A.酸式滴定管未用標準鹽酸潤洗就直接注入標準鹽酸 |
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈后沒有干燥 |
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失 |
D.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數 |
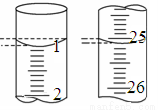
(3)若滴定開始和結束時,酸式滴定管中的液面如圖所示,則終點讀數為_____________mL。
(4)某學生根據3次實驗分別記錄有關數據如表:
滴定次數 | 待測NaOH溶液的體積/mL | 0.100 0 mol/L鹽酸的體積/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
依據上表數據列式計算該NaOH溶液的物質的量濃度為___________mol/L。(保留四位有效數字)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省高二上第一次月考化學試卷(解析版) 題型:選擇題
有等體積、等pH的Ba(OH)2、KOH和NH3·H2O三種堿溶液,滴加等濃度的鹽酸將它們恰好中和,用去酸的體積分別為V1、V2、V3,則三者的大小關系正確的是( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省高二上第一次月考化學試卷(解析版) 題型:選擇題
一定溫度下,水中存在H2O?H++OH- △H>0的平衡,下列敘述一定正確的是
A.向水中滴入少量稀鹽酸,平衡逆向移動,Kw減小
B.將水加熱,Kw增大,pH減小
C.向水中加入少量CH3COONa固體,平衡逆向移動,c(H+)降低
D.向水中加入少量Na2SO4固體,平衡不移動,c(H+)一定為10-7 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高二上第一次月考化學試卷(解析版) 題型:填空題
在某溫度下、容積均為2L的三個密閉容器中,按不同方式投入反應物,保持恒溫恒容,使之發生反應:2A2(g)+BC(g) X(g) △H=-dkJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達到平衡時的有關數據如下:
X(g) △H=-dkJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達到平衡時的有關數據如下:
實驗 | 甲 | 乙 | 丙 |
初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
平衡時n(X) | 0.5mol | n2 | n3 |
反應的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
體系的壓強 | P1 | P2 | P3 |
反應物的轉化率 | α1 | α2 | α3 |
(1)在該溫度下,假設甲容器從反應開始到平衡所需時間為4 min,則該時間段內A2的平均反應速率v(A2) 。
(2)該溫度下此反應的平衡常數K的值為 。
(3)三個容器中的反應分別達平衡時各組數據關系正確的是 (填序號)。
A.α1+α2=1
B.Q1+Q2=d
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
(4)在其他條件不變的情況下,在第5min將甲容器的體系體積壓縮到1L,若在第8min達到新的平衡時A2的總轉化率為65.5%,請在下圖中畫出第5min到新平衡時X的物質的量濃度的變化曲線。
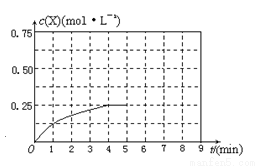
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com