
【題目】[化學-選修3:物質結構與性質]
(1)丙酮(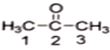 )分子中2號碳原子的雜化方式為__________;
)分子中2號碳原子的雜化方式為__________;
(2)寫出鎳原子的電子排布式_____________;
(3)H2O分子的鍵角比NH3分子的鍵角小,原因是_____________________________________ ;
(4)N、P、As屬于同族元素,它們的簡單氫化物沸點由大到小的順序為_________________(用化學式表示),其原因是 ____________________________________;
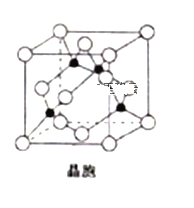
(5)由銅與氯形成的一種化合物的晶胞結構如圖所示(黑點代表銅原子)。
①將晶胞內的4個黑點相互連接所形成的立體構型是______________;
②晶體中與一個氯原子距離最近的氯原子有___________個;
③已知該晶體的密度為ρg.cm-3,阿伏加德羅常數(shù)的值為NA,則該晶體中銅原子和氯原子之間的最短距離為____________pm(列出計算式即可);
【答案】sp2雜化 1s22s22p63s23p63d84s2或[Ar]3d84s2。 NH3中存在1對孤電子對,H2O中存在2對孤電子對,孤對子對數(shù)越多,和其他電子發(fā)生排斥作用越大,鍵角越小。 NH3>AsH3> PH3 NH3分子間有氫鍵,沸點最高,AsH3的相對分子質量比PH3大 正四面體型 12 (31/2/4) ×[4×99.5/ (NA×ρ)]1/3×1010
【解析】
(1)丙酮(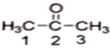 )分子中2號碳原子的雜化方式為sp2雜化。
)分子中2號碳原子的雜化方式為sp2雜化。
(2)鎳元素原子核外有28個電子,電子排布式為:1s22s22p63s23p63d84s2或[Ar]3d84s2。
(3)NH3、H2O分子中心原子都是sp3雜化, NH3中存在1對孤電子對,H2O中存在2對孤電子對,孤對子對數(shù)越多,和其他電子發(fā)生排斥作用越大,鍵角越小。
(4)對于組成和結構相似的分子晶體,比較熔沸點大小時,先看有沒有氫鍵, 沒有氫鍵,再看相對分子質量,一般都是相對分子質量越大,熔沸點越高。
(5)①由該晶胞可以看出,與金剛石晶胞相似,所以晶胞內的四個黑點相互連接,可以組
成一個正四面體形。
②晶胞是孤立體系,周圍有無數(shù)晶胞重疊,從底心的Cl看出,周圍最近的原子有8個,下面一個晶胞有4個,因此在它周圍最近的Cl有12個。
③設晶胞邊長為acm,則一個晶胞的體積為a3cm3,一個晶胞中含有4個Cu,含有4個Cl,則1個晶胞的質量為m=(4×64+4×35.5)/NA g=(4×99.5/NA)g,因為密度為ρg.cm-3,所以晶胞邊長a=[4×99.5/ (NA×ρ)]1/3cm;CuCl的晶胞與金剛石晶胞相似,所以該晶體中銅原子和氯原子之間的最短距離為體對角線的四分之一,即(31/2/4) ×[4×99.5/( NA×ρ)]1/3cm=(31/2/4) ×[4×99.5/( NA×ρ)]1/3×1010pm。
(1)丙酮中羰基碳原子與兩個甲基碳原子和一個氧原子相連,丙酮( )分子中2號碳原子的雜化方式為sp2雜化,故答案為:sp2雜化。
)分子中2號碳原子的雜化方式為sp2雜化,故答案為:sp2雜化。
(2)鎳元素原子核外有28個電子,電子排布式為:1s22s22p63s23p63d84s2或[Ar]3d84s2,故答案為:1s22s22p63s23p63d84s2或[Ar]3d84s2。
(3)NH3、H2O分子中心原子都是sp3雜化, NH3中存在1對孤電子對,H2O中存在2對孤電子對,孤對子對數(shù)越多,和其他電子發(fā)生排斥作用越大,鍵角越小,故答案為:NH3中存在1對孤電子對,H2O中存在2對孤電子對,孤對子對數(shù)越多,和其他電子發(fā)生排斥作用越大,鍵角越小。
(4)NH3分子間有氫鍵,氫鍵比分子間作用力大,所以沸點最高;對于組成和結構相似的分子晶體,相對分子質量越大,沸點越高,As的相對原子質量大于P,所以沸點:NH3>AsH3> PH3,故答案為:NH3>AsH3> PH3;NH3分子間有氫鍵,沸點最高,AsH3的相對分子質量比PH3大。
(5)①由該晶胞可以看出,與金剛石晶胞相似,所以晶胞內的四個黑點相互連接,可以組
成一個正四面體形,故答案為:正四面體型。
②晶胞不應作為孤立體系而存在,周圍有無數(shù)晶胞重疊,從底心的Cl看出,周圍最近的Cl原子有8個(4個頂點和鄰近的4個面心),下面一個晶胞有4個(鄰近的4個面心),因此在它周圍最近的Cl有12個,故答案為:12。
③設晶胞邊長為acm,則一個晶胞的體積為a3cm3,一個晶胞中含有4個Cu,含有4個Cl,則1個晶胞的質量為m=(4×64+4×35.5/NA)g=(4×99.5/NA)g,因為密度為ρg.cm-3,所以晶胞邊長a=[4×99.5/ (NA×ρ)]1/3cm;CuCl的晶胞與金剛石晶胞相似,所以該晶體中銅原子和氯原子之間的最短距離為體對角線的四分之一,即:(31/2/4) ×(4×99.5/ NA×ρ)1/3cm=(31/2/4) ×[4×99.5/ (NA×ρ)]1/3×1010pm。故答案為:(31/2/4) ×[4×99.5/ (NA×ρ)]1/3×1010pm。


科目:高中化學 來源: 題型:
【題目】恒溫恒壓條件下發(fā)生反應:N2(g)+3H2(g)![]() 2NH3(g),若將2 mol氮氣和3 mol氫氣充入密閉容器中,反應達平衡時,氨氣的體積分數(shù)為a。保持相同條件,在密閉容器中分別充入下列物質, 反應達平衡時,氨氣的體積分數(shù)可能為a的是( )
2NH3(g),若將2 mol氮氣和3 mol氫氣充入密閉容器中,反應達平衡時,氨氣的體積分數(shù)為a。保持相同條件,在密閉容器中分別充入下列物質, 反應達平衡時,氨氣的體積分數(shù)可能為a的是( )
A. 2 mol N2和6 mol H2 B. 1 mol N2和2 mol NH3
C. 1 mol N2、3 mol H2和2 mol NH3 D. 2 mol N2、3 mol H2和1 mol NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g) ![]() 2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是
2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是

A. 該反應的逆反應為吸熱反應,升高溫度可提高活化分子的百分數(shù)
B. 500℃、101kPa下,將1molSO2(g)和0.5molO2(g)置于密閉容器中充分反應生成SO3(g)放熱akJ,其熱化學方程式為2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 該反應中,反應物的總鍵能小于生成物的總鍵能
D. ΔH=E1-E2,使用催化劑可以加快反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某體系內有反應物和生成物5種物質:FeCl3、FeCl2、H2S、S、HCl,已知FeCl2為生成物,則另一生成物是
A. FeCl3 B. H2S C. S D. HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將燃著的鎂條伸入盛有二氧化碳的集氣瓶中,鎂條繼續(xù)燃燒,反應的化學方程式為:CO2+2Mg=C+2MgO,該反應屬于:①化合反應②分解反應③置換反應④復分解反應⑤氧化還原反應⑥離子反應⑦非氧化還原反應( )
A.①③⑦B.③⑤C.②③⑥D.④⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如果M、SO42-、Mg2+和Na+四種離子以物質的量之比為2∶4∶1∶2共同存在于同一種溶液中,那么M可能是
A. Ba2+ B. CO32- C. Cu2+ D. Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海水里可以提取溴,主要反應為2Br﹣+Cl2=2Cl﹣+Br2,下列說法正確的是( )
A.溴離子具有氧化性B.氯氣是還原劑
C.該反應屬于復分解反應D.Br2是氧化產(chǎn)物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在1L恒容密閉容器中加入lmol的N2(g)和3molH2(g)發(fā)生反應:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物質的量與時間的關系如下表所示,下列說法不正確的是( )
2NH3(g) △H<0, NH3的物質的量與時間的關系如下表所示,下列說法不正確的是( )
時間(min) | 0 | t1 | t2 | t3 |
NH3物質的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3時再加入1mol的N2(g)和3molH2(g),反應達新平衡時,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高溫度,可使正反應速率減小,逆反應速率增大,故平衡逆移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于甲苯的性質中,能說明苯環(huán)對側鏈產(chǎn)生影響的是 ( )
A. 甲苯硝化生成三硝基甲苯
B. 甲苯能使酸性高錳酸鉀溶液褪色
C. 甲苯與溴蒸汽混合光照可生成![]()
D. 甲苯與氫氣可以發(fā)生加成反應
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com