
【題目】25℃時,體積均為25.00mL,濃度均為0.0100mo1L-1的HA、H3B溶液分別用0.0100mo1L-1NaOH溶液滴定,溶液的pH隨V(NaOH)變化曲線如圖所示,下列說法正確的是( )
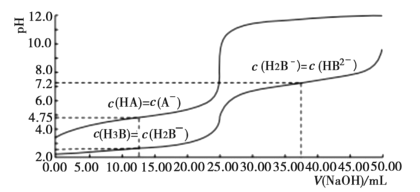
A.25℃時,0.0100mo1L-1Na2HB溶液的pH>7
B.向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA)
C.NaOH溶液滴定HA溶液應選甲基橙作指示劑
D.25℃時,H2B-離子的水解常數的數量級為10-3
【答案】A
【解析】
A. 25℃時,0.0100mo1L-1Na2HB溶液,根據c(H2B-)=c(HB2-)時,溶液顯堿性,可知HB2-水解程度大于電離程度,溶液pH>7,A正確;
B. 根據c(HA)=c(A-)時,溶液顯酸性,可知A-水解程度小于HA電離程度,繼續加入氫氧化鈉,HA濃度減小,到達中性時,c(A-)>c(HA),B錯誤;
C. NaOH溶液滴定HA溶液時,滴定突躍pH在6.0到8.0之間,甲基橙在pH大于4.4時即為黃色,不能作指示劑,應用酚酞做指示劑,C錯誤;
D. 25℃時,根據c(H2B-)=c(H3B)時,pH=2.0,H2B-離子的水解常數K=![]() ,數量級為10-12,D錯誤;
,數量級為10-12,D錯誤;
答案為A。


科目:高中化學 來源: 題型:
【題目】1mol有機物X最多能與1 mol HCl發生加成反應得到Y,1 mol Y能與4 mol Cl2在一定條件下發生取代反應得到Z。已知Y分子中的碳碳鍵都是單鍵,Z分子中沒有氫原子,則X的結構簡式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是(用NA表示阿伏加德羅常數的值)
A. 17g羥基(-OH)所含有的電子數是10 NA個
B. 常溫下,14g乙烯含有的共用電子對數是2.5NA個
C. 12 g石墨中含有C﹣C鍵的個數為1.5NA
D. 標準狀況下,CH4發生取代反應生成22.4LCH2Cl2,需要消耗2NA個Cl2分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究煤的合理利用及 CO2的綜合應用有著重要的意義。請回答以下問題:
I.煤的氣化
已知煤的氣化過程涉及的基本化學反應有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查閱資料反應②中相關化學鍵能數據如下表:
化學鍵 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)則反應②中 a =_____________。
(2)煤直接甲烷化反應 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=為 _____kJ mol-1, 該反應在_____________(填“高溫”或“低溫 ”)下自發進行。
CH4(g) 的△H=為 _____kJ mol-1, 該反應在_____________(填“高溫”或“低溫 ”)下自發進行。
II.合成低碳烯烴
在體積為1 L 的 密閉容器中,充入 1mol CO2和 2 .5 mol H2, 發生 反應: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,測得溫度對催化劑催化效率和CO2 平衡轉化率的影響如右圖 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,測得溫度對催化劑催化效率和CO2 平衡轉化率的影響如右圖 所 示 :
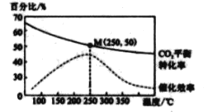
(3) 圖中低溫時, 隨著溫度升高催化劑的催化效率提高, 但 CO2的平衡轉化率卻反而降低 ,其原因是_______________.
(4) 250℃時,該反應的平衡常數K 值為____________。
III.合成甲醇
在恒溫 2 L 容積不變的密閉容器中,充入 1molCO2 和 3 molH2, 發生反應:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),測得不同時刻反應前后容器內壓強變化(p后/p前)如下表:
CH3OH(g)+ H2O(g),測得不同時刻反應前后容器內壓強變化(p后/p前)如下表:
時間/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反應前 1 小時內的平均反應速率 v(H2)為_______molL-1h-1 , 該溫度下CO2的平衡轉化率為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】要“打贏藍天保衛戰”,意味著對污染防治比過去要求更高。某種利用垃圾滲透液實現發電、環保二位一體相結合的裝置示意圖如圖,當該裝置工作時,下列說法正確的是( )
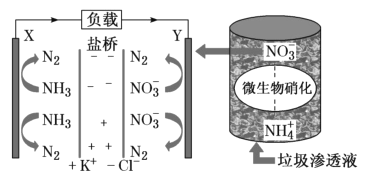
A.鹽橋中K+向X極移動
B.電路中流過7.5mol電子時,共產生標準狀況下N2的體積為44.8L
C.該裝置實現了將電能轉化為化學能
D.Y極發生的反應為2NO3--10e-+6H2O=N2↑+12OH-,周圍pH增大
查看答案和解析>>
科目:高中化學 來源: 題型:
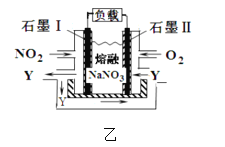
【題目】用下圖甲所示裝置電解飽和食鹽水制Cl2、H2和NaOH。
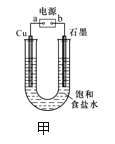
(1)b為電源的______極,Cu極的電極反應式為________。
(2)某同學在進行上述實驗時,發現銅電極下方產生紅色沉淀,石墨電極上產生無色無味的氣體,則該同學將石墨連接到了電源的______極。
(3)電解粗銅制精銅時,可采用NO2、O2和熔融NaNO3制作的燃料電池作電源,其原理如圖,該電池在使用過程中石墨 I電極上生成氧化物Y,則其正極的電極反應為:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na3OCl是一種良好的離子導體,具有反鈣鈦礦晶體結構。
回答下列問題:
(1)基態Ti原子4s軌道上的一個電子激發到4p軌道上形成激發態,寫出該激發態價層電子排布式__。第三電離能:Ca__Ti(填“大于”或“小于”)。
(2)由O、Cl元素可組成不同的單質和化合物,其中Cl2O2能破壞臭氧層。
①Cl2O2的沸點比H2O2低,原因是__。
②O3分子的中心原子雜化類型為___;與O3互為等電子體的是__(任意寫一種)。
(3)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl![]() 2Na3OCl+H2↑,在該反應中,形成的化學鍵有__(填標號)。
2Na3OCl+H2↑,在該反應中,形成的化學鍵有__(填標號)。
A.金屬鍵 B.離子鍵 C.配位鍵 D.極性鍵 E.非極性鍵
(4)Na3OCl晶體屬于立方晶系,其晶胞結構如圖所示。已知:晶胞參數為anm,密度為dgcm3。

①Na3OCl晶胞中,O位于各頂點位置,Cl位于__位置。
②用a、d表示阿伏加德羅常數的值NA=__(列計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列檢驗某溶液中是否含有SO![]() 的方法中正確的是( )
的方法中正確的是( )
A.向該溶液中加入酸化的Ba(NO3)2溶液出現白色沉淀,說明溶液中一定有SO![]()
B.向該溶液中加入BaCl2溶液出現白色沉淀,說明該溶液中一定有SO![]()
C.向該溶液中加入足量HCl,無現象,再加入BaCl2溶液出現白色沉淀,說明該溶液中一定有SO![]()
D.向該溶液中加入BaCl2溶液,產生白色沉淀,再加入HCl沉淀不溶解,說明該溶液中一定有SO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素及其化合物在生產生活中至關重要。
(1)BF3與一定量水形成(H2O)2·BF3晶體Q,Q在一定條件下可轉化為R:

晶體Q中含有的化學鍵包括____________________。
(2) NF3與NH3的空間構型相同,但NF3不易與Cu2+等形成配位鍵,其原因是___________。
(3)PCl5是一種白色晶體,在恒容密閉容器中加熱可在148 ℃液化,形成一種能導電的熔體,測得其中含有陰陽離子各一種,結構是正四面體型離子和正八面體型離子;正八面體型離子的化學式為_________________________;正四面體型離子中鍵角大于PCl3的鍵角原因為______________________________________________________。
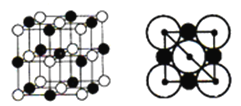
(4)氯化鈉的晶胞結構如圖所示,圖是氯化鈉的晶胞截面圖(圖中球大小代表半徑大小)。已知NA代表阿伏加德羅常數的值,氯化鈉晶體的密度為d g·cm-3。則Na+半徑為____________pm(只需列出計算式)。
(5)砷化硼為立方晶系晶體,該晶胞中原子的分數坐標為:
B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……
);……
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……
);……
①請在圖中畫出砷化硼晶胞的俯視圖______。
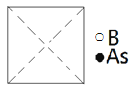
②砷原子緊鄰的硼原子有________個,與每個硼原子緊鄰的硼原子有______個。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com