
【題目】利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟。
(1)T1℃時,在2L密閉容器中充入0.6molSO3,圖1表示SO3物質的量隨時間的變化曲線。

①平衡時,SO3的轉化率為______(保留一位小數);在T1℃下反應2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常數為____________;若其他條件不變,在8min時壓縮容器的體積至1L,則n(SO3)的變化曲線為_______(填字母)。
2SO3(g) 的平衡常數為____________;若其他條件不變,在8min時壓縮容器的體積至1L,則n(SO3)的變化曲線為_______(填字母)。
②下表為不同溫度(T)下反應2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化學平衡常數(K):
2SO3(g) △H<0的化學平衡常數(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他條件相同,在T1、T2、T3三種不同溫度下,反應從開始至達到平衡時所需要的時間最長的是 _____________。(填“T1”、“T2”或“T3”)
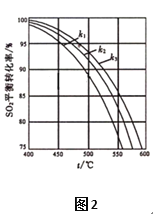
(2)在體系恒壓的條件下進行反應:2SO2(g)+O2(g) ![]() 2SO3(g),原料氣中SO2和O2的物質的量之比(k)不同時,SO2的平衡轉化率與溫度(t)的關系如圖2所示:圖中k1、k2、k3的大小順序為____________。
2SO3(g),原料氣中SO2和O2的物質的量之比(k)不同時,SO2的平衡轉化率與溫度(t)的關系如圖2所示:圖中k1、k2、k3的大小順序為____________。
【答案】 66.7% 2.5 c T2 k1>k2>k3
【解析】(1)在容積為2L密閉容器中充入0.6molSO3,由圖1平衡時SO3物質的量為0.2mol,
2SO2(g)+O2(g) 2SO3(g),
起始量(mol)0 0 0.6
變化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
①SO3的轉化率為=![]() ×100%≈66.7%;K=
×100%≈66.7%;K=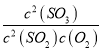 =
=![]() =2.5;其他條件不變,在8min時壓縮容器體積至0.5L,平衡向正反應方向移動,n(SO3)變大,即為圖像c,故答案為:66.7%;2.5; c;
=2.5;其他條件不變,在8min時壓縮容器體積至0.5L,平衡向正反應方向移動,n(SO3)變大,即為圖像c,故答案為:66.7%;2.5; c;
②因為反應為放熱反應,溫度越低,平衡越向正反應方向移動,平衡常數越大,所以溫度最低的為K最大的,即T2,故答案為:T2;
(2)相同溫度和壓強下,K越小,氧氣濃度越大,平衡正向移動,則二氧化硫的轉化率越大,則k1>k2>k3,故答案為:k1>k2>k3。


 優等生題庫系列答案
優等生題庫系列答案科目:高中化學 來源: 題型:
【題目】某化學實驗需要450 mL 0.10 mol·L-1 Na2CO3溶液,某同學選用Na2CO3·10H2O晶體進行配制,簡要回答下列問題:
(1)該實驗應選擇__________mL容量瓶。
(2)需稱取Na2CO3·10H2O的質量為__________g。
(3)該實驗的正確操作順序是_______________(填字母代號)。
A.用托盤天平稱取Na2CO3·10H2O晶體
B.上下顛倒搖勻
C.用膠頭滴管加水至刻度線
D.洗滌所用儀器并將洗滌液轉移進容量瓶
E.將所稱取的晶體溶于蒸餾水并冷卻至室溫
F.將溶液轉入容量瓶
(4)另需配制一定濃度的NaOH溶液,稱量時若將NaOH固體置于濾紙上稱量,則所配溶液濃度______;若容量瓶中有檢漏時殘留的少量蒸餾水,會使所配溶液濃度______;NaOH溶解后未經______;立即注入容量瓶至刻度線,會使濃度______;定容時必須使凹液面最低處與刻度線相切,若仰視會使所配溶液濃度______(凡涉及濃度變化填“偏高”、“偏低”或“無影響”)。
(5)向200 mL所配的 0.10 mol·L-1Na2CO3溶液中逐滴加入10 mL 12.25%稀H2SO4(ρ=1.0 g/cm3),理論上能收集到標準狀況下的氣體__________mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機物在一定條件下,既能發生消去反應,又能發生水解反應的是( )
①CH3Cl ② ![]() ③
③ ![]() ④
④![]()
A. ①② B. ②③④ C. ② D. ①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
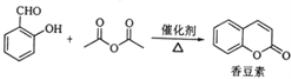
【題目】香豆素是一種天然香料,存在于黑香豆、蘭花等植物中.工業上常用水楊醛與乙酸酐在催化劑存在下加熱反應制得:
以下是由甲苯為原料生產香豆素的一種合成路線(部分反應條件及副產物已略去)
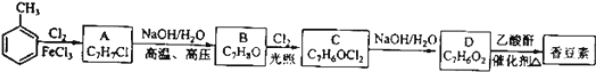
(A- C7H7Cl B- C7H8O C- C7H6OCl2 D-C7H6O2 )
已知以下信息:
①A中有五種不同化學環境的氫
②B可與FeCl3溶液發生顯色反應
③同一個碳原子上連有兩個羥基通常不穩定,易脫水形成羰基.
請回答下列問題:
(1)香豆素的分子式為 ____________ ;
(2)A的化學名稱為 ____________
(3)由B生成C的化學反應方程式為 ______________ ;
(4)B的同分異構體中含有苯環的還有 ______ 種,其中在核磁共振氫譜中只出現四組峰的有 ______ 種;
(5)D的同分異構體中含有苯環的還有 ____________ 種,其中:
①既能發生銀境反應,又能發生水解反應的是 ______________ (寫結構簡式)
②能夠與飽和碳酸氫鈉溶液反應放出CO2的是 ______________ (寫結構簡式)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用二氧化錳和濃鹽酸共熱的方法制取氯氣。根據要求回答下列問題。
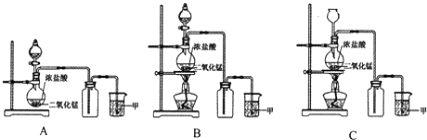
(1)A、B、C三套裝置中,應選用的裝置是____________(選填“A”、“B”、“C”);
(2)寫出制取氯氣的化學方程式_________________________________________。
(3)為了防止氯氣污染環境,圖中溶液甲中發生的化學反應方程式___________________。
(4)由于氯氣貯存運輸不方便,工業上常將氯氣轉化為漂白粉,工業上生產漂白粉的主要化學方程式是_____________________,在空氣中漂白粉長期存放會變質而失效的原理是(用化學方程式說明) ___________________________________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某含鉻污泥主要含Cr2O3、Al2O3、Fe2O3等物質,該污泥可以用濕法回收利用,流程如下圖所示:
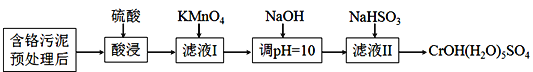
已知:室溫下部分氫氧化物的Ksp見下表
Al(OH)3 | Fe(OH)3 | Cr(OH)3 | Mn(OH)2 | |
Ksp | 3×10-34 | 4×10-38 | 6×10-31 | 4×10-14 |
(1)酸浸前,對含鉻污泥進行預處理即加水濕磨成漿體,濕磨的作用是_____________。
(2)向濾液I加KMnO4氧化Cr3+的離子方程式是________________________________;將Cr3+氧化的目的是____________________________________________________。
(3)室溫下,調pH=10時, ![]() =_____;調溶液pH不能大于10,理由是_________。
=_____;調溶液pH不能大于10,理由是_________。
(4)NaHSO3在反應中的作用是___________;理論上n(NaHSO3):n[CrOH(H2O)5SO4]之比是_______________。
(5)NaHSO3固體在空氣中易變質,寫出檢驗NaHSO3是否變質的方法______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三聚氰胺污染牛奶事件社會影響極壞。向牛奶和奶粉中添加三聚氰胺,主要是因為它能冒充蛋白質。已知三聚氰胺中含有碳、氫、氮三種元素,其相對分子質量為126。為測定三聚氰胺的組成,用下列各儀器裝置,在過量的氧氣流中將2.52g三聚氰胺樣品氧化成CO2、H2O和N2。回答下列問題:
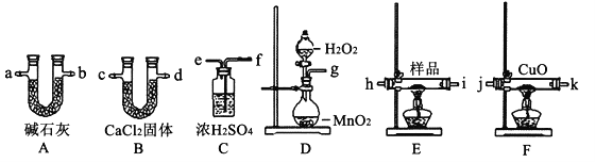
(1)產生的氧氣按從左向右的流向,所選裝置各導管的連接順序是g接_______、____接___、____接j、k接___、____接___。
(2)裝置F中CuO的作用是__________________________________________________。
(3)實驗前后稱得A、B兩裝置的質量分別增加2.64g和1.08g,則三聚氰胺的分子式為_________________。
(4)按(1)的連接方法,此實驗裝置存在的缺點是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺顆粒物),冬季空氣污染嚴重也跟冬季燃煤密切相關。
SO2、CO、CO2也是對環境影響較大的氣體,對它們的合理控制、利用是優化我們生存環境的有效途徑。
(1)PM2.5是指大氣中直徑小于或等于2.5微米的可入肺的有害顆粒,下列有關說法中正確的是______(填字母)。
a.PM2.5在空氣中一定能形成氣溶膠
b.PM2.5比表面積大能吸附大量的有毒有害物質
c.PM2.5 主要來源于直接排放的工業污染物和汽車尾氣等
d.酸雨、臭氧層破壞等環境問題與PM2.5無關
(2)有一種用CO2生產甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-a kJmol-1
CH3OH(g)+H2O(g) △H=-a kJmol-1
2H2(g)+O2(g)=2H2O(g) △H=-b kJmol-1
H2O(g)-H2O(l) △H=-c kJmol-1
CH3OH(g)=CH3OH(l) △H=-d kJmol-1
則表示CH3OH(l)燃燒熱的熱化學方程式為________________________________。
(3)工業上還可以通過下列反應制備甲醇:CO(g)+2H2(g)![]() CH3OH(g)。在一容積可變的密閉容器中充入10molCO和20molH2,CO的平衡轉化率隨溫度(T)、壓強(p)的變化如圖所示。
CH3OH(g)。在一容積可變的密閉容器中充入10molCO和20molH2,CO的平衡轉化率隨溫度(T)、壓強(p)的變化如圖所示。
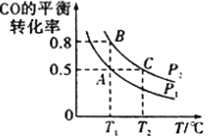
①下列說法不能判斷該反應達到化學平衡狀態的是______(填字母)。
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的體積分數不再改變
c.體系中H2的轉化率和CO的轉化率相等
d.體系中氣體的平均摩爾質量不再改變
②比較A、B兩點壓強大小PA_____ PB (填“>”、“<”或“=”)。
③若達到化學平衡狀態A時。容器的體積為20L。如果反應開始時仍充入10molCO和20molH2,則在平衡狀態B時容器的體積V(B)=____________L。
(4)SO2在一定條件下可與氧氣構成原電池。右圖是利用該電池在鐵表面鍍銅的裝置示意圖:
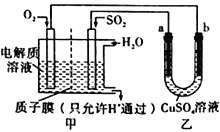
①該電池的負極反應:__________________________________;質于膜(只允許H通過)
②當甲中消耗2.24 LO2(標準狀況)時,乙中__________(填“a”或“b”)增重_________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應2H2O2(l)![]() 2H2O(l)+O2(g)能量變化如圖所示,下列說法正確的是
2H2O(l)+O2(g)能量變化如圖所示,下列說法正確的是
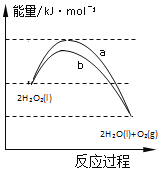
A. 由于分解反應,所以該反應吸熱
B. 途徑b改變了反應的熱效應
C. 1 molH2O2(l)的能量高于1 molH2O(l)的能量
D. 途徑a放出的熱量多
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com