
【題目】已知:某二元酸H2XO4在水中電離分兩步:H2XO4=H++HXO4-,HXO4-![]() H++XO42-。常溫下,在20mL0.1molL-1NaHXO4溶液中滴加cmolL-1NaOH溶液,溶液溫度與溶液體積關系如圖所示。下列說法錯誤的是( )
H++XO42-。常溫下,在20mL0.1molL-1NaHXO4溶液中滴加cmolL-1NaOH溶液,溶液溫度與溶液體積關系如圖所示。下列說法錯誤的是( )
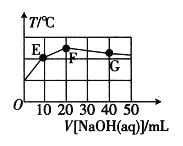
A.該NaOH溶液的pH=13
B.滴加過程中,水的電離程度先變大,后變小
C.F點溶液中c(OH-)>c(HXO4-)
D.G點溶液中c(Na+)=3c(H2XO4)+3c(HXO4-)+3c(XO42-)
【答案】D
【解析】
根據圖像可知,NaHXO4與NaOH發生反應是放熱反應,當溫度達到最高,說明兩者恰好完全反應,F點溫度最高,此時消耗NaOH的體積為20mL,計算出氫氧化鈉的濃度,然后根據影響水電離的因素、“三大守恒”進行分析;
A. 根據圖像分析可知,F點溫度最高,說明此時兩物質恰好完全反應,![]() ,20×10-3L×0.1mol·L-1=20×10-3L×c(NaOH),推出
,20×10-3L×0.1mol·L-1=20×10-3L×c(NaOH),推出![]() ,
,![]() ,故A說法正確;
,故A說法正確;
B. 根據題意,兩者恰好完全反應,生成的溶質Na2XO4,屬于強堿弱酸鹽,即溶質為![]() 時水解程度最大,E到F過程中,水的電離程度增大,F到G過程中,氫氧化鈉溶液過量,抑制水的電離,因此滴加氫氧化鈉的過程中,水的電離程度先變大,后變小,故B說法正確;
時水解程度最大,E到F過程中,水的電離程度增大,F到G過程中,氫氧化鈉溶液過量,抑制水的電離,因此滴加氫氧化鈉的過程中,水的電離程度先變大,后變小,故B說法正確;
C. F點溶質為![]() ,溶液中質子守恒為
,溶液中質子守恒為![]() ,所以
,所以![]() ,故C說法正確;
,故C說法正確;
D. 依題意,![]() 第一步完全電離,溶液中不存在
第一步完全電離,溶液中不存在![]() ,故D說法錯誤;
,故D說法錯誤;
答案:D。


科目:高中化學 來源: 題型:
【題目】在0.1 mol/L的Na2CO3溶液中,下列關系式正確的是( )
A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/LD.c(HCO3-)<c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由于具有超低耗電量、壽命長的特點,LED產品越來越受人歡迎。下圖是氫氧燃料電池驅動LED發光的裝置。下列有關敘述正確的是( )
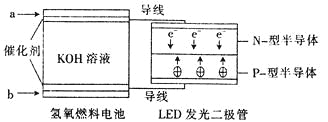
A.a處通人氧氣,b處通人氫氣
B.該裝置中只涉及兩種形式的能量轉化
C.電池正極電極反應式為O2+2H2O+4e-﹦4OH-
D.P一型半導體連接的是電池負極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤是重要的能源,也是生產化工產品的重要原料。試用所學知識,解答下列問題:
(1)煤的轉化技術包括煤的氣化技術和液化技術。煤的液化技術又分為________和________。
(2)在煤燃燒前需對煤進行脫硫處理。煤的某種脫硫技術的原理為FeS2![]() Fe2++SO42—
Fe2++SO42—![]() Fe3+這種脫硫技術稱為微生物脫硫技術。該技術的第一步反應的離子方程式為_______________________,第二步反應的離子方程式為________________。
Fe3+這種脫硫技術稱為微生物脫硫技術。該技術的第一步反應的離子方程式為_______________________,第二步反應的離子方程式為________________。
(3)工業煤干餾得到的產品有焦炭、________。
(4)工業上主要采用氨氧化法生產硝酸,如圖是氨氧化率與氨-空氣混合氣中氧氨比的關系。其中直線表示反應的理論值;曲線表示生產實際情況。當氨氧化率達到100%,理論上r[n(O2)/n(NH3)]=________,實際生產要將r值維持在1.7~2.2之間,原因是__________________________________________。
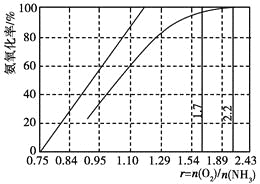
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項敘述中,正確的是
A.C6H5CH2CH2OH與C6H5OH互為同系物
B.CH3CHO與CH3COOH在一定條件下均能與新制氫氧化銅反應
C.![]() 與
與![]() 互為同分異構體
互為同分異構體
D.H2O與D2O互為同素異形體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在強堿溶液中加熱R﹣Br 容易水解為R﹣OH.某芳香烴A有如下轉化關系:
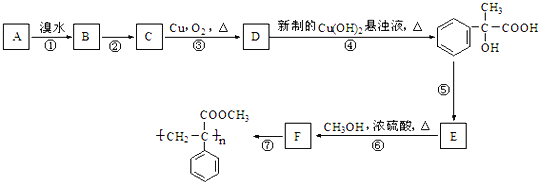
請回答下列問題:
(1)反應①到⑥中消去反應是:_______________。
(2)反應②的條件為:_______________。
(3)A結構簡式:_______________。
(4)反應③化學方程式:______________________________________________________。
(5)在E的粗產物中,經檢測含有高分子聚合物雜質。寫出該高聚物雜質的結構簡式:____________。
(6)寫出滿足下列條件的E的一種同分異構體的結構簡式:_______________。
Ⅰ.苯環上的一元取代物只有兩種結構;
Ⅱ.能發生銀鏡反應
Ⅲ.與氯化鐵溶液發生顯色反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】探究草酸(H2C2O4)的性質,室溫下進行以下兩組實驗:(已知:室溫下,H2C2O4的電離平衡常數Ka1=5.0×10-2,Ka2=5.4×10-5)
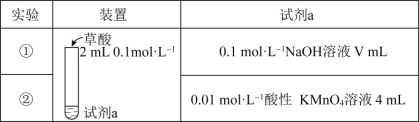
下列有關實驗說法正確的是( )
A.若實驗①中V=2,則混合后溶液中:c(C2O42-)>c(H2C2O4)
B.若實驗①中V=4,則混合后溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
C.實驗②反應的離子方程式為5C2O42-+16H++2MnO4-=2Mn2++10CO2↑+8H2O
D.若實驗②測得KMnO4溶液的褪色時間為40s,則這段時間內的平均反應速率v(KMnO4)=2.5×10-4molL-1s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是( )
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是( )

A.d點沒有AgCl沉淀生成
B.c點對應的Ksp等于a點對應的Ksp
C.加入AgNO3,可以使溶液由c點變到d點
D.加入少量水,平衡右移,Cl-濃度減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,電解質溶液的性質與變化是多樣的,下列說法正確的是
A.往稀氨水中加水,溶液中的![]() 值變小
值變小
B.pH相等的①CH3COONa、②NaClO、③NaOH三種溶液中c(Na+)大小:①>②>③
C.pH=4的H2S溶液與pH=10的NaOH溶液等體積混合,存在下列等式:c(Na+)+c(H+)=c(OH-)+2c(S2-)
D.Ca(ClO)2溶液中通入少量CO2,ClO-水解程度增大,溶液堿性增強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com