
下列離子方程式書寫正確的是
A.實驗室用氯化鐵溶液制取氫氧化鐵膠體:Fe3++3H2O Fe(OH)3(膠體)+3H+ Fe(OH)3(膠體)+3H+ |
| B.碳酸鈣溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C.鋁和燒堿溶液:2Al+2OH-+2H2O=2Al3++3H2↑ |
| D.AlCl3溶液中加入過量氨水:Al3++4OH- =AlO2-+2H2O |
A
解析試題分析:判斷離子方程式正確與否的方法一般是:(1)檢查反應能否發生。(2)檢查反應物、生成物是否正確。(3)檢查各物質拆分是否正確。(4)檢查是否符合守恒關系(如:質量守恒和電荷守恒等)。(5)檢查是否符合原化學方程式。A、氫氧化鐵膠體不能拆開,所以實驗室用氯化鐵溶液制取氫氧化鐵膠體的離子方程式為Fe3++3H2O Fe(OH)3(膠體)+3H+,A正確;B、醋酸是弱酸不能拆開,則碳酸鈣溶于醋酸的離子方程式為CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,B不正確;C、鋁與燒堿反應的離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,C不正確;D、氨水是弱堿不能溶解氫氧化鋁,則AlCl3溶液中加入過量氨水的離子方程式為Al3++3NH3·H2O=Al(OH)3↓+3NH4+,D不正確,答案選A。
Fe(OH)3(膠體)+3H+,A正確;B、醋酸是弱酸不能拆開,則碳酸鈣溶于醋酸的離子方程式為CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,B不正確;C、鋁與燒堿反應的離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,C不正確;D、氨水是弱堿不能溶解氫氧化鋁,則AlCl3溶液中加入過量氨水的離子方程式為Al3++3NH3·H2O=Al(OH)3↓+3NH4+,D不正確,答案選A。
考點:考查離子方程式的正誤判斷


科目:高中化學 來源: 題型:單選題
下列各組中兩種物質在溶液的反應,能用同一離子方程式表示的是
| A.鐵和稀鹽酸、鐵和稀硝酸 |
| B.銅和濃硝酸、銅和稀硝酸 |
| C.NaHCO3+ NaOH;NaHSO4+ NaOH |
| D.BaCl2+ H2SO4; Ba(OH)2+ Na2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在指定的條件下,下列各組離子一定能大量共存的是
| A.無色的溶液中:Fe3+、K+、NO3-、Cl- |
| B.pH=13的溶液中:NH4+、Na+、SO42-、Cl- |
| C.含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、H+ |
| D.c(H+)=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
常溫下,下列各組離子在指定溶液中一定能大量共存的是
| A.使甲基橙變紅的溶液:Fe2+、K+、SO42-、NO3- |
| B.加入鋁粉產生氫氣的溶液:Na+、K+、SO42-、Cl- |
| C.0.1 mol·L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| D.水電離出的c(H+)=10-12 mol·L-1的溶液:Na+、K+、NH4+、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在透明溶液中,下列各組離子能大量共存的是
| A.HCO3-、ClO-、K+、H+ | B.Na+、Fe2+、NO3-、H+ |
| C.K+、Cu2+、Cl-、SO42- | D.OH-、NH4+、Cl-、SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列離子方程式中,書寫正確的是
A.弱酸酸式鹽NaHB在水溶液中水解:HB–+H2O H3O++B2– H3O++B2– |
B.電解飽和食鹽水:C1-+2H2O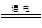 H2↑+Cl2↑+OH- H2↑+Cl2↑+OH- |
| C.氫氧燃料電池在堿性介質中的正極反應式:O2+2H2O+4e一=4OH- |
| D.FeBr2溶液中通入過量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某溶液中含大量NH4+、Na+、HCO3-、CO32-、CH3COO-離子,其中加入足量的Na2O2固體后,溶液中離子濃度基本保持不變的是(假設溶液體積無變化)
| A.Na+ | B.CO32-、NH4+ | C.CH3COO- | D.CH3COO-、Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
解釋下列現象的化學用語正確的是( )
A.鐵釘在空氣中出現紅色的鐵銹,其負極反應式為:Fe-3e- Fe3+ Fe3+ |
B.氫氧化鎂白色沉淀溶于氯化銨溶液:Mg(OH)2+2N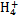  Mg2++2NH3·H2O Mg2++2NH3·H2O |
C.SO2通入到滴加酚酞的NaOH溶液中,紅色變淺:SO2+2OH- S S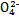 +H2O +H2O |
D.向K2Cr2O7溶液中加入少量NaOH濃溶液,溶液由橙色變為黃色:Cr2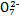 +H2O +H2O 2Cr 2Cr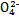 +2H+ +2H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com