
(8分)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(過二硫酸鉀),溶液會發
如下反應:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
該反應常用于檢驗Mn2+的存在。其特征現象是_________________。
若反應中有0.1 mol還原劑參加反應,則消耗氧化劑物質的量__________mol。
(2)若該反應所用的硫酸錳改為氯化錳,當它跟過量的過硫酸鉀反應時,除有高錳酸鉀、硫酸鉀、硫酸生成外,其他的生成物還有_________________。
(3)將NaBiO3固體(黃色微溶)加入到MnSO4和H2SO4的混合溶液里加熱,固體溶解變為澄清溶液,發生如下反應:
NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反應的化學方程式,并標出電子轉移的方向和數目;
②上述反應中還原產物是
(1)溶液由無色變為紫色 0.25 (2)Cl2
(3)10 4 14 = 3 5 4 14 (2)Bi2(SO4)3
【解析】(1)由于MnO4-在溶液中顯紫紅色,所以現象是溶液由無色變為紫色;還原劑是Mn2+,化合價從+2價升高到+7價,所以失去5個電子;氧化劑中S的化合價從+7價降低到+6價,得到1個電子,所以1mol氧化劑得到2mol電子,因此若反應中有0.1 mol還原劑參加反應,則消耗氧化劑物質的量0.25mol。
(2)由于在反應中氯離子也能被氧化,所以還生成氯氣。
(3)根據方程式可知,Bi的化合價從+5價降低到+3價,得到2個電子。MnSO4中Mn的化合價從+2價升高到+7價,失去5個電子,所以氧化劑是NaBiO3,還原劑是MnSO4,二者的物質的量之比是5︰2,其中還原產物是Bi2(SO4)3,氧化產物是NaMnO4,因此方程式為
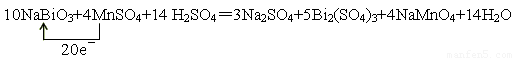


科目:高中化學 來源: 題型:
| O | - 3 |
| O | 2- 8 |
| O | - 4 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2013屆甘肅省蘭州一中高三9月月考化學試卷(帶解析) 題型:填空題
(8分)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(過二硫酸鉀),溶液會發
如下反應:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
該反應常用于檢驗Mn2+的存在。其特征現象是_________________。
若反應中有0.1 mol還原劑參加反應,則消耗氧化劑物質的量__________mol。
(2)若該反應所用的硫酸錳改為氯化錳,當它跟過量的過硫酸鉀反應時,除有高錳酸鉀、硫酸鉀、硫酸生成外,其他的生成物還有_________________。
(3)將NaBiO3固體(黃色微溶)加入到MnSO4和H2SO4的混合溶液里加熱,固體溶解變為澄清溶液,發生如下反應:
NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反應的化學方程式,并標出電子轉移的方向和數目;
②上述反應中還原產物是
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com