
【題目】CCl3CHO是一種藥物合成的中間體,可通過CH3CH2OH + 4Cl2 → CCl3CHO+5HCl進行制備。制備時可能發(fā)生的副反應為C2H5OH + HCl→C2H5Cl + H2O、CCl3CHO+HClO—CCl3COOH+HCl。合成該有機物的實驗裝置示意圖(加熱裝 置未畫出)和有關數(shù)據(jù)如下:


(1)A中恒壓漏斗的作用是______;A裝置中發(fā)生反應的化學方程式為_____。
(2)裝置B的作用是____;裝置F在吸收氣體時,為什么可以防止液體發(fā)生倒吸現(xiàn)象______。
(3)裝置E中的溫度計要控制在70℃,三口燒瓶采用的最佳加熱方式是______。如果要在球形冷凝管中注入冷水增加冷凝效果,冷水應該從_____(填“a”或“b”)口通入。實驗使用球形冷凝管而不使用直形冷凝管的目的是________。
(4)實驗中裝置C中的試劑是飽和食鹽水,裝置中D的試劑是濃H2SO4。如果不使用D裝置,產(chǎn)品中會存在較多的雜質_______(填化學式)。除去這些雜質最合適實驗方法是______。
(5)利用碘量法可測定產(chǎn)品的純度,反應原理如下:
CCl3CHO+NaOH→CHC13+HCOONa
HCOONa+I2=HI+NaI+CO2
I2+2Na2S2O3=2NaI+Na2S4O8
稱取該實驗制備的產(chǎn)品5.00 g,配成100.00 mL溶液,取其中10.00 mL,調節(jié)溶液 為合適的pH后,加入30.00 mL 0.100 mol L-1的碘標準液,用0 100 mol L-1的 Na2S2O3溶液滴定,重復上述3次操作,消耗Na2S2O3溶液平均體積為20.00 mL,則該次實驗所得產(chǎn)品純度為_________。
【答案】保持漏斗和反應容器內的氣壓相等 2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O 安全瓶(或防止裝置C中液體倒吸入裝置A中) 漏斗口徑較大,被吸住的液體會迅速回落燒杯中 水浴 b 增大蒸氣與外界接觸面積,提高冷凝回流效果 C2H5Cl、CCl3COOH 蒸餾 59%
【解析】
A裝置利用高錳酸鉀與濃鹽酸制備氯氣,C裝置用飽和食鹽水除去HCl,D裝置盛放濃硫酸干燥氯氣,E中反應制備CCl3CHO。F裝置盛放氫氧化鈉溶液,吸收尾氣中氯氣、HCl防止污染空氣。
(1)A中的恒壓漏斗使得漏斗中的壓強和圓底燒瓶中的壓強相同,從而濃鹽酸能夠順利流下。高錳酸鉀與濃鹽酸反應生成氯氣,方程式為2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)裝置B中的導管很短,而且B中沒有試劑,所以是作安全瓶,防止C裝置處理HCl氣體時發(fā)生倒吸。裝置F中倒扣的漏斗,與液體接觸的部分橫截面積很大,被吸住的液體會迅速回落燒杯中,不會發(fā)生倒吸。答案為安全瓶 漏斗口徑較大,被吸住的液體會迅速回落燒杯中;
(3)溫度要控制在70℃,未超過水的沸點100℃,可以選擇水浴加熱,即最佳的加熱方式為水浴加熱。冷凝過程中,冷凝管中應該充滿水,所以冷水應該從b口進。球形冷凝管與蒸氣接觸的面積大,冷凝回流效果更好。 答案為:水浴 b 增大蒸氣與外界接觸面積,提高冷凝回流效果;
(4)如果沒有濃硫酸干燥,則E中會有水參加反應,水與氯氣反應生成HCl和HClO,副反應就會發(fā)生,生成的產(chǎn)物有C2H5Cl、CCl3COOH。從圖表所給的信息來看,雜質均溶于乙醇,得到一混合液體,且沸點相差較大,使用蒸餾,可以分離除去;
(5)加入的碘單質被硫代硫酸鈉和CCl3CHO消耗,加入的碘單質的物質的量為0.03L ×0.100 mol L-1=0.003mol,消耗的Na2S2O3的物質的量為0.02L ×0.100 mol L-1=0.002mol。有關系式為
I2 ~CCl3CHO I2 ~ 2Na2S2O3
0.001mol 0.002mol
CCl3CHO消耗碘單質的物質的量為0.003-0.001mol=0.002mol,則10mL的溶液中含有CCl3CHO的物質的量為0.002mol。100mL溶液中含有CCl3CHO為0.02mol,質量為0.02mol×147.5g=2.95g,則純度![]() 。
。


科目:高中化學 來源: 題型:
【題目】鐵、鈷、鎳及其化合物有許多用途。回答下列問題:
(1)基態(tài)鐵原子核外共有____________種不同空間運動狀態(tài)的電子,鐵、鈷、鎳基態(tài)原子核外未成對電子數(shù)最少的價層電子的電子排布圖(軌道表達式)為_________________。
(2)酞菁鈷分子的結構簡式如圖甲所示,分子中與鈷原子通過配位鍵結合的氮原子的編號是______(填“1”“2”“3”或“4”),分子中三種非金屬原子的電負性由大到小的順序為____________(用相應的元素符號表示),分子中碳原子的雜化軌道類型為____________。

(3)高鐵酸鉀(K2FeO4)是一種新型、高效、多功能綠色水處理劑,該晶體固態(tài)下不導電,熔融狀態(tài)、水溶液均能導電,該晶體屬于__________(填晶體類型)。配合物Fe(CO)x的中心原子價電子數(shù)與配體提供電子數(shù)之和為18,則x=__________。
(4)NiO、FeO的晶體結構類型與氯化鈉的相同,Ni2+和Fe2+的離子半徑分別為69pm和74pm,則熔點NiO__________FeO(填“>”“<”或“=”),原因是______________________________。
(5)Ni、O、Cr可以形成一種具有特殊導電性的復合氧化物,晶胞結構如圖乙所示,晶胞邊長為apm,阿伏加德羅常數(shù)的值為NA,其晶體密度的計算表達式為_______g·cm-3;晶胞中Cr4+位于O2-所形成的正八面體的體心,該正八面體的邊長為_________pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某合作學習小組討論辨析下列說法,其中說法正確的數(shù)目為
①離子反應可能是復分解反應,但一定不是氧化還原反應②電解質在水中一定能導電,非電解質在水中一定不導電③CO2的水溶液可以導電,故 CO2是電解質④同溫同壓下,等質量的二氧化硫氣體和二氧化碳氣體密度比為 16:11,體積比為 11:16⑤某固體中加入稀鹽酸,產(chǎn)生了無色氣體,證明該固體中一定含有碳酸鹽
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化硼(BN)是一種重要的功能陶瓷材料以天然硼砂為起始物,經(jīng)過一系列反應可以得到BF3和BN,如下圖所示:
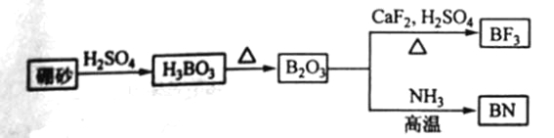
請回答下列問題:
(1) 由B2O3制備BF3、BN的化學方程式依次是_________、__________;
(2) 基態(tài)B原子的電子排布式為_________;B和N相比,電負性較大的是_________,BN中B元素的化合價為_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的雜化軌道類型為_______,BF3和過量NaF作用可生成NaBF,BF的立體結構為_______;
(4) 在與石墨結構相似的六方氮化硼晶體中,層內B原子與N原子之間的化學鍵為________,層間作用力為________;
(5)六方氫化硼在高溫高壓下,可以轉化為立方氮化硼,其結構與金剛石相似,硬度與金剛石相當,晶苞邊長為361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必計算出數(shù)值,阿伏伽德羅常數(shù)為NA)。
(只要求列算式,不必計算出數(shù)值,阿伏伽德羅常數(shù)為NA)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質投入溶液中,溶液質量減輕的是( )
A.CaCO3投入到HCl溶液中
B.Na2CO3投入稀硫酸中
C.Fe粉投入CuSO4溶液中
D.Fe粉投入稀HCl溶液中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從鐵、鹽酸、氧氣、水、硝酸銀溶液五種物質中選出一種或兩種作反應物,按下列要求的反應類型各寫一個化學方程式。
(1)化合反應_______;
(2)分解反應________;
(3)置換反應________;
(4)復分解反應_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】滴滴涕(DDT)是20世紀60年代以前廣為應用的一種殺蟲劑,其結構簡式為

DDT因其穩(wěn)定性、脂溶性、藥效普適性等特點而大量使用,最終造成環(huán)境污染。下列關于DDT的說法,不正確的是( )
A.DDT也能殺死有益的生物
B.DDT極易溶于水
C.DDT是烴的衍生物
D.DDT不易被生物分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳減排和再利用技術是促進工業(yè)可持續(xù)發(fā)展和社會環(huán)保的重要措施。將工業(yè)廢氣中的二氧化碳轉化為甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol
H2O(g)+CH3OH(g) △H=-53.7kJ/mol
(1) 308K時,向2L密閉容器中通入0.04 mol CO2和0.08 mol H2,測得其壓強(p)隨時間(t)變化如圖1中曲線I所示。


①反應開始至達平衡時,υ(H2)=________;該溫度下反應的平衡常數(shù)為______mol-2·L2。
②若只改變某一條件,其他條件相同時,曲線變化為II,則改變的條件是____。
(2)還可以通過以下途徑實現(xiàn)CO2向CH3OH的轉化:
反應I:CO2(g)+H2(g)![]() H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反應Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
反應I和反應Ⅱ的平衡常數(shù)K隨溫度T的變化如圖2所示。
①根據(jù)圖中數(shù)據(jù)分析可知,T1____T2(填“>”、“<”或“=”);T2時CO2轉化為CH3OH的平衡常數(shù)K=_______;
②目前,許多國家采用CO2代替CO(以煤和天然氣為原料)生產(chǎn)CH3OH,其優(yōu)點是_________。
(3)用電解法可將CO2轉化為多種燃料,原理如圖3。銅電極上產(chǎn)生HCOOH的電極反應式為_________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗所得結論正確的是

A. ①中溶液紅色褪去的原因是:CH3COOC2H5 + NaOH =CH3COONa + C2H5OH
B. ②中溶液變紅的原因是:CH3COO- + H2O ![]() CH3COOH + H+
CH3COOH + H+
C. 由實驗①、②、③推測,①中紅色褪去的原因是乙酸乙酯萃取了酚酞
D. ④中紅色褪去證明右側小試管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com