
將堿溶液A、鹽溶液B按如下程序進行實驗,根據下述現象判斷: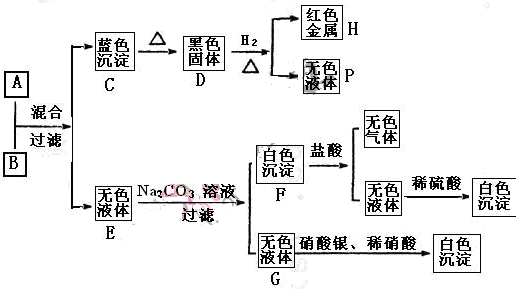
(1)A的化學式 B的化學式 。
(2)完成下列轉化的化學方程式,并用“單線橋法”標明電子轉移的方向和數目:
D+H2=H+P:
(3) 寫出下列反應的離子方程式:
A+B:
F+鹽酸:
(4)鹽溶液B中陰離子的檢驗方法是
(1)Ba(OH)2 CuCl2
(2)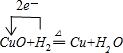
(3)Cu2++2OH-=Cu(OH)2↓ Ba CO3+2H+=Ba 2++CO2↑+H2O
(4)取少量B溶液于試管中,滴加硝酸銀溶液產生白色沉淀,再滴加稀硝酸沉淀不溶解。
解析試題分析:由轉化關系圖知,H為紅色金屬,則H為Cu,采用逆推法,D為黑色固體CuO,C為藍色沉淀Cu(OH)2,P為H2O;采用正推法,堿溶液A+鹽溶液B→Cu(OH)2+無色溶液E,B為銅鹽,由無色溶液E加Na2CO3溶液,過濾得無色溶液G,加硝酸銀和稀硝酸產生白色沉淀,故G為氯化鈉,無色溶液E含有Cl-,故鹽溶液B為CuCl2;由無色溶液E加Na2CO3溶液,過濾得白色沉淀F,加鹽酸產生無色氣體和無色溶液,白色沉淀F為碳酸鹽,該無色溶液加硫酸產生白色沉淀,故無色溶液含有Ba2+,故白色沉淀為BaCO3,無色溶液E含有Cl-,故E為BaCl2,再結合堿溶液A+鹽溶液B→Cu(OH)2+無色溶液E,故A為Ba(OH)2。
(1)由上述分析可知,A為Ba(OH)2;B為CuCl2;(2)D+H2→H+P為: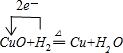 ;
;
(3)A+B反應是氫氧化鋇與氯化銅反應生成氫氧化銅與氯化鋇,反應離子方程式為:Cu2++2OH-=Cu(OH)2↓;F+鹽酸是碳酸鋇與元素反應生成氯化鋇、二氧化碳與水,反應離子方程式為:BaCO3+2H+=Ba2++CO2↑+H2O;(4)CuCl2溶液中陰離子的檢驗方法是:取少量B溶液于試管中,滴加硝酸銀溶液產生白色沉淀,再滴加稀硝酸沉淀不溶解,說明含有Cl-。
考點:以無機框圖題的形式考查C、Cu、Cl、S等元素單質及其化合物之間的相互轉化關系、離子檢驗。


科目:高中化學 來源: 題型:填空題
在下圖所示的物質轉化關系中,A是海水中含量最豐富的鹽,B是常見的無色液體,G的水溶液是一種常用的漂白劑,F是地殼中含量最多的金屬元素。(反應中生成的水和部分反應條件未列出)
(1)畫出A中陰離子的結構示意圖 。
(2)反應②在點燃條件下的現象是 。
(3)H轉化為F的氫氧化物最好選擇的試劑是 。
(4)反應③的離子方程式為 。
(5)反應④的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中學常見化學反應方程式為:A+B→X+Y+H2O(未配平,反應條件略去),其中,A、B的物質的量之比為1:4。請回答:
(1)若Y為黃綠色氣體,該反應的離子方程式為 ,B體現出的化學性質有
(2)若A為常見的非金屬單質,B的溶液為某濃酸,反應條件為加熱,其反應的化學方程式為
(3)若A為某不活潑的金屬單質,實驗室常用該反應來制備某種能形成酸雨的氣體,該反應中氧化劑與還原劑的物質的量之比為
(4)若A為常見的金屬單質,常溫下A在B的濃溶液中“鈍化”,且A可溶于X溶液中。
①A元素在元素周期表中的位置是
②含amolX的溶液溶解了一定量A后,若溶液中兩種金屬陽離子的物質的量恰好相等,則被還原的X的物質的量是
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
如下圖表示有關物質之間的轉化關系,其中X是一種正鹽,Y是一種強酸,C是淡黃色固體,E是常見的金屬單質.(反應①⑥⑦⑧⑨中的部分產物已略去).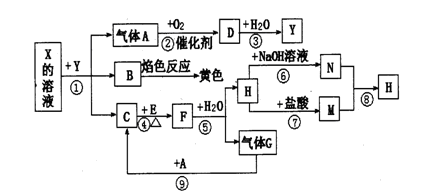
請回答下列問題:
(1)固體C的晶體類型是 ,F的化學式是 。
(2)工業上要實現A—D D—Y的轉化需要的設備分別是 、 。
(3)在反應⑨中的氧化劑與還原劑的物質的量之比是 。
(4)反應⑧的離子方程式為 。
(5)正鹽X中酸根離子中除氧元素外另一種元素的平均化合價可能為( )。
| A.+4價 | B.-2價 | C. 0價 | D.+2價 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A+B→X+Y+H2O(未配平,反應條件略去)是中學常見反應的化學方程式,其中A、B的物質的量之比為1:4。請回答:
(1)若Y是黃綠色氣體,則該反應的離子方程式是 _____________________________;將Y與等物的量的SO2充分混合后通入品紅溶液,未見其褪色,原因是__________________________________________(請用化學方程式解釋說明)。
(2)若A為非金屬單質,構成它的原子核外最外層電子數是次外層電子數的2倍,B的溶
液為某濃酸,則反應所得的氧化產物的化學式為 。
(3)若A為金屬單質,常溫下A在B的濃溶液中“鈍化”,而且A可溶于X溶液中:
① A元素的元素符號為 ,則A與B的反應中氧化劑與還原劑的物質的量之比是 。
② 若含a mol X的溶液溶解了一定量A后,此時溶液中兩種金屬陽離子的物質的量恰好相等,則被還原的X的物質的量為 mol(用含a代數式表示);為保證A與B充分反應后最終所得的溶液中同時含有上述兩種金屬陽離子,則此時B與A的質量比應滿足的取值范圍是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、D、E、F六種物質的相互轉化關系如圖所示(反應條件及部分產物未列出)。
(1)若A是常見金屬單質,與B的水溶液反應生成C和D。D、F是氣體單質,D在F中燃燒時發出蒼白色火焰。則F所對應的元素在周期表位置是 ;反應②(在水溶液中進行)的離子方程式為 。
(2)若A、D為短周期元素組成的固體單質,A為金屬,D為非金屬。且③④兩個反應都有紅棕色氣體生成,則反應①、④的化學方程式分別為
① ;④ 。
(3)若A、D、F都是短周期非金屬單質,且A、D所含元素同主族,A、F所含元素同周期,C是一種能與血紅蛋白結合的有毒氣體;則物質B的晶體類型是 ,分子E的結構式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知A、B、D為中學常見的單質,甲、乙、丙、丁、戊為短周期元素組成的化合物。其中,丙是一種能使濕潤的紅色石蕊試紙變藍的無色氣體;丁是一種高能燃料,其組成元素與丙相同,1 mol丁分子中不同原子的數目比為1:2,且含有18 mol電子;戊是一種難溶于水的白色膠狀物質,既能與強酸反應,也能與強堿反應,具有凈水作用。各物質間的轉化關系如下圖所示(某些條件已略去)。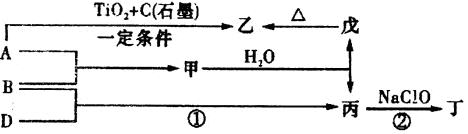
請回答:.
(1)單質B的組成元素在周期表中的位置是 。
(2)戊的化學式為 。戊與強堿反應的離子方程式: 。
(3)NaClO的電子式為 。
(4)甲與水反應的化學方程式為 。
(5)反應②中,0.5molNaClO參加反應時,轉移1mol電子,其化學方程式為: 。
(6)一定條件下,A與TiO2、C(石墨)反應只生成乙和碳化鈦(TiC),二者均為某些高溫結構陶瓷的主要成分。已知該反應生成1mol乙時放出536 kJ熱量,其熱化學方程式為: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下列實驗流程圖中,X為第三周期兩種重要單質的氧化物的混合物。反應②、④是工業上的重要反應,部分物質及反應條件沒有列出。
請回答下列問題:
(1)寫出A、E、B的化學式:A________, E___________,B___________。
(2)寫出C溶液轉化為C固體的過程中,HCl氣流的作用:________________________。
(3)寫出①、③、④反應的化學方程式,(若是離子反應寫離子方程式)
①__________________________________________________;
③__________________________________________________;
④__________________________________________________。
(4)將SO2氣體分別通入下列溶液寫出對應的實驗現象
①BaCl2溶液________________________________;
②Ba(NO3)2溶液_____________________________________;
⑨FeCl3溶液_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列依據相關實驗得出的結論正確的是 ( )
| A.將(NH4)2SO4、CuSO4溶液分別加入蛋白質溶液,都出現沉淀,表明二者均可使蛋白質變性 |
| B.過量的銅屑與稀硝酸反應停止后,再加入1 mol/L稀硫酸,銅屑又逐漸溶解,且有無色氣體產生,銅可直接與1 mol/L稀硫酸反應 |
| C.將常溫下呈氣態的某有機物通入溴水中,溴水褪色,該氣體分子中一定含碳碳雙鍵或碳碳三鍵 |
| D.向某溶液中滴加KSCN溶液,溶液不變色,滴加氯水后溶液顯紅色,該溶液中一定含Fe2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com