
【題目】氫氣是一種清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。
(1)在700℃時,向容積為2L的密閉容器中充入一定量的CO和H2O,發生反應:CO(g)+H2O(g)![]() CO2(g)+H2(g),反應過程中測定的部分數據見下表(表中t2 > t1):
CO2(g)+H2(g),反應過程中測定的部分數據見下表(表中t2 > t1):
反應時間/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | 0.80 |
①反應在t1min內的平均速率:v(H2)=____mol·L-1·min-1。
②t2時刻,該反應的正反應速率___逆反應速率(填“大于”、“小于”或“等于”)。
(2)氫氧燃料電池可以使用在航天飛機上,其反應原理示意圖如圖。
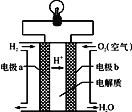
①該電池供電時,____能轉化為____能。
②寫出該電池供電時的總反應方程式________。
③電極b上發生______反應(“氧化”或“還原”)。
④在外電路中,電子流動的方向為________。
(3)鎂鋁合金(Mg17Al10)是一種潛在的貯氫材料,可在氬氣保護下,將一定化學計量比的Mg、Al單質在一定溫度下熔煉獲得。該合金在一定條件下完全吸氫的反應方程式為Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定條件下可釋放出氫氣。
①鎂鋁合金的熔點比金屬鎂的熔點______。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全釋放出H2。1 mol Mg17Al10完全吸氫后得到的混合物Y與足量上述鹽酸完全反應,釋放出H2的物質的量為______。
【答案】0.2/t1 等于 化學 電 2H2+O2=2H2O 還原 由a到b 低 49
【解析】
(1)①根據表格數據首先計算v(CO),再根據速率之比=化學計量數之比計算v(H2);②反應在t2時刻為平衡狀態;
(2)氫氧燃料電池中,氫氣易失電子發生氧化反應,所以通入氫氣的電極a是負極,氧氣易得電子發生還原反應,所以通入氧氣的電極b是正極,電流由正極電極b通過導線流向負極電極a,據此分析解答;
(3)①合金的熔點比成分金屬的熔點低;②釋放出的H2 包括Mg17Al12吸收的氫,還包括鎂、鋁和鹽酸反應生成的氫氣。
(1)①根據表格數據,反應在t1min時達到平衡狀態,v(CO)= =
=![]() mol·L-1·min-1,則v(H2)=v(CO)=
mol·L-1·min-1,則v(H2)=v(CO)=![]() mol·L-1·min-1,故答案為:
mol·L-1·min-1,故答案為:![]() ;
;
②根據表格數據t2時刻為平衡狀態,反應的正反應速率等于逆反應速率,故答案為:等于;
(2)①燃料電池中,將化學能轉化為電能,故答案為:化學;電;
②氫氧燃料電池的總反應式為2H2+O2═2H2O,故答案為:2H2+O2═2H2O;
③氫氧燃料電池中通入氧氣的電極b是正極,發生還原反應,故答案為:還原;
④在原電池中電子從負極沿導線流向正極,a是負極、b是正極,則電子由電極a通過導線流向電極b,故答案為:由a到b;
(3)①合金的熔點比成分金屬的熔點低,因此鎂鋁合金的熔點比金屬鎂的熔點低,故答案為:低;
②根據反應的方程式,1molMg17Al10完全吸氫17mol,在鹽酸中會全部釋放出來,鎂鋁合金中的鎂和鋁都能與鹽酸反應生成H2,生成氫氣的物質的量分別為17mol、10×![]() =15mol,則生成氫氣一共(17+17+15)mol=49mol,故答案為:49mol。
=15mol,則生成氫氣一共(17+17+15)mol=49mol,故答案為:49mol。


科目:高中化學 來源: 題型:
【題目】下圖為周期表中短周期的一部分,W、X、Y、Z四種元素最外層電子數之和為24。下列說法正確的是
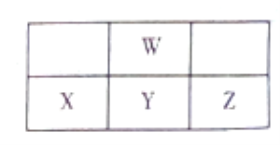
A. X、Y、Z的含氧酸的酸性依次增強
B. W元素形成的單核陰離子還原性強于X
C. Y、W形成的化合物一定能使酸性KMnO4溶液褪色
D. W與氫元素形成的化合物中可能含有非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A. NH4+中質子數和電子數相等 B. 乙醇比乙二醇的沸點低
C. 乙炔與苯的實驗式均為 CH D. 過氧化鈉與過氧化氫中均含有非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列情況可能引起大氣污染的是( )
①煤的燃燒;②工業廢氣任意排放;③燃放鞭炮;④飛機、汽車尾氣的排放
A.只有①②B.只有②④
C.只有①②④D.只有①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦酸鋇(BaTiO3)在工業上有重要用途,主要用于制作電子陶瓷、PTC熱敏電阻、電容器等多種電子元件。以下是生產鈦酸鋇的一種工藝流程圖:
![]()
已知:①草酸氧化鈦鋇晶體的化學式為BaTiO(C2O4)2·4H2O;
(1)BaTiO3中Ti元素的化合價為:__________。
(2)用鹽酸酸浸時發生反應的離子方程式為: ________________________________。
(3)流程中通過過濾得到草酸氧化鈦鋇晶體后,為提高產品質量需對晶體洗滌。
①過濾操作中使用的玻璃儀器有__________________________________________。
②如何證明晶體已洗凈?_________________________________________。
(4)某興趣小組取19.70gBaCO3模擬上述工藝流程制備BaTiO3,得產品13.98g,BaTiO3的產率為:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學利用氧化還原反應:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O設計如下原電池,鹽橋中裝有飽和KCl溶液。下列說法正確的是

A. b電極上發生還原反應
B. 外電路電子的流向是從a到b
C. 電池工作時,鹽橋中的SO42-移向甲燒杯
D. a電極上發生的反應為:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,在固定容積的密閉容器中,能表示反應X(氣)+2Y(氣)![]() 2Z(氣)一定達到化學平衡狀態的是( )
2Z(氣)一定達到化學平衡狀態的是( )
A.容器內壓強不隨時間改變
B. c(X).c(Y)2=c(Z)2
C.正反應生成Z的速率與逆反應生成X的速率相等
D.容器內混合氣體的密度不隨時間改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知自然界氧的同位素有16O , 17O ,18O,若氫的同位素有H、D、T,從水分子的原子組成來看,自然界的水一共有幾種
A.18種B.6種C.9種D.12種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究金屬橋墩腐蝕及防護是跨海建橋的重要課題。下列有關判斷中正確的是


A. 用裝置①模擬研究時未見a上有氣泡,說明鐵沒有被腐蝕
B. ②中橋墩與外加電源正極連接能確保橋墩不被腐蝕
C. ③中采用了犧牲陽極的陰極保護法保護橋墩
D. ①②③中海水均是實現化學能與電能相互轉化的電解質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com