
【題目】I.分別取等物質的量濃度的氫氧化鈉溶液各100 mL,再通入一定量的CO2,隨后分別各取10 mL溶液,向其中逐滴滴入0.2 mol·L-1的鹽酸,在標準狀況下產生CO2的體積(y軸)與所加入鹽酸的體積(x軸)的關系如下圖(分A、B兩種情況):
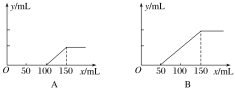
(1)在A情況下,溶質是________________(填化學式),其物質的量之比為________。
(2)原氫氧化鈉溶液的物質的量濃度為________________。
II.足量的兩份鋁分別投入到等體積、等物質的量濃度的鹽酸和氫氧化鈉溶液中,產生H2的體積之比是__________________。
III.向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL濃度為2.0 mol·L-1的鹽酸,恰好使混合物完全溶解,放出224 mL的氣體(標準狀況),所得溶液中加入KSCN溶液后無血紅色出現。若用足量的CO在高溫下還原相同質量的此混合物,能得到鐵的質量是________,解題依據是_________________
【答案】NaOH和Na2CO3 1:1 3mol/L 1:3 5.6g 原子守恒(或質量守恒)
【解析】
I.向NaOH溶液中通入CO2,隨著CO2的通入,溶質有4種情況:NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3。鹽酸滴入反應后的溶液中,HCl先和NaOH反應,再和Na2CO3反應:CO32-+H+=HCO3-,最后再發生HCO3-+H+=H2O+CO2↑。
II.根據鋁和鹽酸、氫氧化鈉反應的方程式解答。
III.根據原子守恒解答。
I.(1)在A情況下,加入100mL(HCl的物質的量為0.1L×0.2 mol·L-1=0.02mol)鹽酸后開始有氣體放出,再加入50mL鹽酸(HCl的物質的量為0.05L×0.2 mol·L-1=0.01mol)氣體達到最多,所以溶質是NaOH和Na2CO3。根據上面的方程式,0.01molHCl消耗0.01mol NaHCO3
,即有0.01mol Na2CO3,0.01molNa2CO3消耗0.01molHCl,另外的0.01molHCl是和NaOH發生反應消耗的,所以NaOH的物質的量也是0.01mol,所以NaOH和Na2CO3物質的量之比為1:1。
(2)加入150mL鹽酸時,溶液中的溶質只有NaCl,根據原子守恒,在取出的10mL反應后的溶液中,n(NaOH)=n(HCl)=0.15L×0.2 mol·L-1=0.03mol,所以原氫氧化鈉溶液的物質的量濃度為![]() =3mol/L。
=3mol/L。
II.鋁和鹽酸、氫氧化鈉溶液反應的化學方程式分別為:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,鹽酸和氫氧化鈉溶液的體積、物質的量濃度都相等,即溶質的物質的量相等,設HCl和NaOH均為6mol,則產生的氫氣分別為3mol和9mol,同溫同壓下物質的量之比等于體積比,所以產生H2的體積之比是3:9=1:3。
III.向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL濃度為2.0 mol·L-1的鹽酸(含HCl的物質的量為0.1L× 2.0 mol·L-1=0.2mol),恰好使混合物完全溶解,所得溶液中加入KSCN溶液后無血紅色出現,說明溶液中的溶質只有FeCl2。根據氯元素守恒,n(FeCl2)=![]() n(Cl-)=0.1mol。若用足量的CO在高溫下還原相同質量的此混合物,能得到鐵的物質的量和FeCl2的物質的量相等,即0.1mol,所以鐵的質量是0.1mol×56g/mol=5.6g。解題依據是原子守恒(或質量守恒)。
n(Cl-)=0.1mol。若用足量的CO在高溫下還原相同質量的此混合物,能得到鐵的物質的量和FeCl2的物質的量相等,即0.1mol,所以鐵的質量是0.1mol×56g/mol=5.6g。解題依據是原子守恒(或質量守恒)。


科目:高中化學 來源: 題型:
【題目】一種制氫技術原理如圖所示。容器Ⅰ中發生的某反應a為C(s)+2H2O(g)![]() CO2(g)+2H2(g);ΔH。下列有關說法正確的是( )
CO2(g)+2H2(g);ΔH。下列有關說法正確的是( )
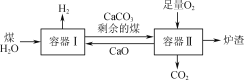
A.已知反應a在一定條件下能夠自發進行,則該反應的ΔH<0
B.向容器Ⅰ中加入CaO能有效實現H2與CO2的分離
C.剩余的煤進入容器Ⅱ是為了充分利用其與O2反應放出的熱量
D.煤中含有的S在容器Ⅱ中最終轉化為CaSO3進入爐渣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(Ⅰ)、如圖為一“鐵鏈”圖案,小明在圖案上分別寫了H2、CO2、Na2O、NaCl、FeCl3五種物質,圖中相連的兩種物質均可歸屬為一類,相交部分A、B、C、D為其相應的分類依據代號。請回答下列問題:
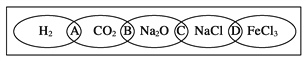
(1)請將分類依據代號填入相應的括號內:
(______)兩種物質都不是電解質
(______)兩種物質都是鹽
(2)用潔凈的燒杯取少量蒸餾水,用酒精燈加熱至沸騰,向燒杯中逐滴加入飽和的圖中某種物質M的溶液加熱至呈紅褐色。
①物質M的化學式為________________。
②證明有紅褐色膠體生成的實驗操作是________________________________________。
(Ⅱ)反應:A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水是氧化劑的是______,水是還原劑的是________。(填序號)
(Ⅲ)反應:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O,還原劑與氧化劑的物質的量之比:_______,當有0.6mol電子轉移時。生成的NO在標準狀況的體積為________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】太陽能的開發利用在新能源研究中占據重要地位,單晶硅太陽能電池片在加工時,一般摻雜微量的銅、鈷、硼、鎵、硒等。回答下列問題:
(1)基態二價銅離子的電子排布式為______,已知高溫下Cu2O比CuO更穩定,試從核外電子排布角度解釋______。
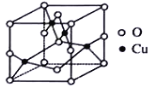
(2)銅的某種氧化物晶胞如圖,該晶胞中陰離子的個數為_________。
(3)銅與(SCN)2反應生成Cu(SCN)2,中心體為___________,HSCN結構有兩種,硫氰酸(H-S-C≡N)的沸點低于異硫氰酸(H-N=C=S)的原因是_________。
(4)BF3能與NH3反應生成BF3·NH3。B與N之間形成配位鍵,氮原子提供_____,第二周期元素中,電離能介于B和N之間的元素有_______個。
(5)如圖EMIM+離子中,碳原子的雜化方式是___________。分子中的大π鍵可用符號πnm表示,其中n代表參與形成大π鍵的原子數,m代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為π66),則EMM+離子中的大π鍵應表示為___________。
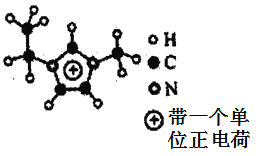
(6)如圖六方氮化硼晶體結構與石墨晶體相似,則六方氮化硼晶體中層間的相互作用為___________。六方氮化硼在高溫高壓下,可以轉化為立方氮化硼,其結構、硬度與金剛石相似,其晶胞如圖,晶胞邊長為361.5pm,立方氮化硼的密度是___________g·cm-3(只列算式,![]() 為阿伏加德羅常數的值)。
為阿伏加德羅常數的值)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工業流程中,進入反應塔的混合氣體中NO和O2的物質的量分數分別為0.10和0.06,發生化學反應2NO(g)+O2(g) ![]() 2NO2(g),在其他條件相同時,測得實驗數據如下表:
2NO2(g),在其他條件相同時,測得實驗數據如下表:
壓強/(×105Pa) | 溫度/℃ | NO達到所列轉化率需要時間/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根據表中數據,下列說法正確的是
A.升高溫度,反應速率加快
B.增大壓強,反應速率變慢
C.在1.0×105 Pa、90℃條件下,當轉化率為98%時反應已達平衡
D.若進入反應塔的混合氣體為a mol,反應速率以![]() 表示,則在8.0×105Pa、30℃條件下,轉化率從50%增至90%時段NO的反應速率為
表示,則在8.0×105Pa、30℃條件下,轉化率從50%增至90%時段NO的反應速率為![]() mols-1
mols-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是( )
①標準狀況下,1LHCl和1LH2O的物質的量相同;
②常溫常壓下,1gH2和14gN2的體積相同;
③28gCO的體積為22.4L;
④兩種物質的物質的量相同,則它們在標準狀況下的體積也相同;
⑤同溫同體積時,氣體的物質的量越大,則壓強越大;
⑥同溫同壓下,氣體的密度與氣體的相對分子質量成正比
A. ①③④⑥B. ②⑤⑥C. ⑤⑥D. ①⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A.澄清石灰水與稀鹽酸反應:Ca(OH)2+2H+=Ca2++2H2O
B.氯氣通入到FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.稀硫酸與氫氧化鋇溶液反應:H++OH-+Ba2++![]() =H2O+BaSO4↓
=H2O+BaSO4↓
D.碳酸氫鈉溶液與氫氧化鉀反應:HCO3-+OH-=H2O+![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一絕熱(不與外界發生熱交換)的恒容容器中,發生反應:2A(g)+B(s) ![]() C(g)+D(g),下列描述中不能表明反應已達到平衡狀態的是( )
C(g)+D(g),下列描述中不能表明反應已達到平衡狀態的是( )
A. 混合氣體的密度不變 B. 單位時間內生成n molD,同時生成n molC
C. 混合氣體的平均相對分子質量不變 D. C(g)的物質的量濃度不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的鎂和鋁混合物投入200 mL稀硫酸中,固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入的NaOH溶液體積的變化關系如圖所示。則下列說法不正確的是( )
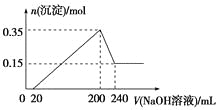
A.鎂和鋁的總質量為9 g
B.合金與稀硫酸反應生成的氫氣體積為10.08 L
C.稀硫酸的物質的量濃度為2.5 mol/L
D.氫氧化鈉溶液的物質的量濃度為5 mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com