
某工廠的廢氣中含有CO、SO2、NO等有毒氣體,為了更有效地治理該廢氣,某研究小組分別設計了如下兩個方案:
方案(1):治理含CO、SO2的煙道氣,以Fe2O3作催化劑,將CO、SO2在380℃時轉化為S和一種無毒氣體。
已知:ⅰ.硫的熔點112.8℃,沸點444.6℃;
ⅱ.反應每得到1mol硫,放出270kJ的熱量。
①寫出該治理煙道氣反應的熱化學方程式: 。
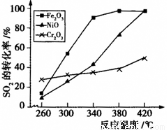
②其他條件相同,催化劑不同時,上述反應中SO2的轉化率隨反應溫度的變化如下圖。不考慮催化劑價格因素,生產中選Fe2O3作催化劑的主要原因是 。
方案(2):用活性炭還原法處理氮氧化物,有關反應為:C(s)+2NO(g) 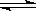 N2(g)+CO2(g)。向某容積為2L 的密閉容器中加入NO和足量的活性炭(固體試樣體積忽略不計),恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2(g)+CO2(g)。向某容積為2L 的密閉容器中加入NO和足量的活性炭(固體試樣體積忽略不計),恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
時間/min 濃度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①10min~20min以v(CO2)表示的反應速率為 。
②根據表中數據,T1℃時該反應的平衡常數為 (保留兩位有效數字)。
③下列各項能作為判斷該反應達到平衡狀態標志的是 (填序號字母)。
A.容器內壓強保持不變
B.2v正(NO)=v逆(N2)
C.容器內CO2的體積分數不變
D.混合氣體的密度保持不變
④30min時改變某一條件,反應重新達到平衡,則改變的條件可能是 ;
⑤一定溫度下,隨著NO的起始濃度增大,NO的平衡轉化率 (填“增大”、“減小”或“不變”)
⑥50min時,保持其他條件不變,往容器中再充入0.32 mol NO和0.34mol CO2,平衡將向 方向移動。
科目:高中化學 來源:2016-2017學年吉林省高一上期初化學卷(解析版) 題型:選擇題
下列各組物質,按化合物、單質、混合物順序排列的是
A.生石灰、白磷、冰水混合物 B.燒堿、液氧、碘酒
C.干冰、鐵、氯化氫 D.純堿、氮氣、膽礬
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省高一上第一次考試化學卷(解析版) 題型:選擇題
下列溶液中,與200mL 0.5mol/L MgCl2溶液所含的Cl-物質的量濃度相同的是
A.100mL 0.25mol/L CaCl2溶液 B.50ml 1mol/L KCl溶液
C.50ml 0.5mol/L NaCl溶液 D.200mL 0.25mol/L AlCl3溶液
查看答案和解析>>
科目:高中化學 來源:2017屆江西省高三上學期第一次月考化學試卷(解析版) 題型:填空題
分現有部分元素的性質與原子(或分子)結構如下表:
元素編號 | 元素性質與原子(或分子)結構 |
X | 地殼中含量最高的非金屬元素 |
Y | M層比K層多1個電子 |
Z | 最外層電子數為內層電子數的0.6倍 |
W | 與氯形成的氯化物是生活中常用的調味品 |
(1)X形成的雙原子分子的結構式為 ,X形成的氫化物的沸點在同族元素形成的氫化物中是 (填“最高”或“最低”),原因是 。
(2)金屬冶煉Y單質的化學方程式為 。
(3)Y單質與W元素的最高價氧化物對應水化物恰好反應完全,向反應后的溶液中通入過量的CO2,發生反應的離子方程式為 。
(4)單質Cu在一定條件下與足量Z元素形成的強酸濃溶液反應生成的氣體是 (填化學式),檢驗該氣體的常用試劑 。
查看答案和解析>>
科目:高中化學 來源:2017屆江西省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列說法錯誤的是( )
A.弱電解質溶液中至少存在兩種共價化合物分子
B.強電解質都是離子化合物,弱電解質都是共價化合物
C.NH3屬于非電解質,但其水溶液能夠導電
D.同位素單質混合在一起一般是純凈物
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三上第12次周測化學卷(解析版) 題型:選擇題
已知A、B、C、D、E是短周期中原子序數依次增大的5種主族元素,其中元素A、E的單質在常溫下呈氣態,元素B的原子最外層電子數是其電子層數的2倍,元素C在同周期的主族元素中原子半徑最大,元素D的合金是日常生活中常用的金屬材料。下列說法正確的是
A. 元素A、B組成的化合物常溫下一定呈氣態
B. 單質沸點:C>D>E
C. 工業上常用電解法制備元素C、D、E的單質
D. 離子半徑:r(C)>r(D)>r(E)
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上10月月考化學試卷(解析版) 題型:填空題
二甲醚(CH3OCH3)和甲醇(CH3OH)被稱為21世紀的新型燃料。以CH4和H2O為原料制備二甲醚和甲醇的工業流程如下:

請填空:
(1)在一定條件下,反應室1中發生反應:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0。將1.0molCH4和2.0molH2O通人反應室1(假設容積為100L),10min末有0.1molCO生成,則10min內反應的平均速率V(H2)=________。該反應平衡常數的表達式:_____________。
CO(g)+3H2(g) △H>0。將1.0molCH4和2.0molH2O通人反應室1(假設容積為100L),10min末有0.1molCO生成,則10min內反應的平均速率V(H2)=________。該反應平衡常數的表達式:_____________。
(2)已知:CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O(g) △H=-1323 KJ/mol;
2H2(g)+O2(g)=2H2O(g) △H=-484 KJ/mol;
CO的燃燒熱:283KJ/mol。
在一定條件下,反應室2的可逆反應除生成二甲醚外還生成了氣態水,該熱化學方程式為_______________。(本題涉及的條件均在同一條件下)
(3) 綠色電源“二甲醚-氧氣燃料電池”的工作原理如右圖所示,寫出X電極的電極反應式_______________

(4)反應室3中在催化劑作用下發生如下反應:CO(g) +2H2(g)  CH3OH(g)。對此反應進行如下研究:
CH3OH(g)。對此反應進行如下研究:
①在容積為1L的密閉容器中分別充入1molCO和2molH2,實驗測得甲醇的物質的量和溫度、時間的關系曲線如圖1所示。
則:該正反應的△H___________0(填“<”、“>”或“=")。
②在容積均為1L的a、b、c三個相同密閉容器中分別充入1mol CO和2mol H2,三個容器的反應溫度分別為T1、T2、T3,在其他條件相同情況下,實驗測得反應均進行到5min時甲醇的體積分數如圖2所示。下列說法正確的是_______________
A.a、b、c三容器5min時的正反應速率大小為:b>a>c
B.達到平衡時,a、b、c三容器中CO轉化率為a>b>c
C.5min時,a、b、c三容器中的反應均可能達到平衡狀態。
D.將容器b中的平衡狀態轉變到容器c中的平衡狀態,可采取的措施有升溫或減壓
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上10月月考化學試卷(解析版) 題型:選擇題
對下列物質的化學用語書寫正確的是( )
A.乙烯的結構簡式為CH2CH2
B.羥基的電子式: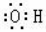
C.Ca2+的結構示意圖為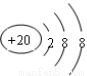
D.乙醇的分子式:CH3CH2OH
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上學期第一次月考化學卷(解析版) 題型:選擇題
(金屬鎳有廣泛的用途。粗鎳中含有少量雜質Fe、Zn、Cu、Pt, 可用電解法制備高純度的鎳(已知:氧化性Fe2+<Ni2+<Cu2+),下列敘述正確的是( )
可用電解法制備高純度的鎳(已知:氧化性Fe2+<Ni2+<Cu2+),下列敘述正確的是( )
A.陽極發生還原反應,其電極反應式:Ni2++2e-=Ni
B.電解過程中,陽極質量的減少與陰極質量的增加相等
C.電解后,溶液中存在的陽離子只有Fe2+和Zn2+
D.電解后,電解槽底部的陽極泥中只有Cu和Pt
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com