
【題目】在一密閉的2 L容器中裝有4 mol SO2和2 mol O2,在一定條件下開始反應。2 min末測得容器中有1.6 mol SO2,請計算:
(1)2 min末SO3的濃度;
(2)2 min內SO2的平均反應速率。
科目:高中化學 來源: 題型:
【題目】工業上通常利用SiO2 和碳反應來制取硅,寫出反應的化學方程式___________________。
工業上還可以利用鎂制取硅,反應為2Mg+SiO2 = 2MgO+Si,同時會發生副反應:2Mg + Si = Mg2Si。如圖是進行Mg與SiO2反應的實驗裝置,試回答下列問題:

(1)由于O2和H2O(g)的存在對該實驗有較大影響,實驗中應通入氣體X作為保護氣,試管中的固體藥品可選用________(填序號)。
a.石灰石 b.鋅粒 c.純堿
(2)實驗開始時,必須先通一段時間X氣體,再加熱反應物,其理由是 ___________________________;當反應引發后,移走酒精燈,反應能繼續進行,其原因是______________________。
(3)反應結束后,待冷卻至常溫時,往反應后的混合物中加入稀鹽酸,可觀察到閃亮的火星,產生此現象的原因是副產物Mg2Si遇鹽酸迅速反應生成SiH4(硅烷)氣體,然后SiH4自燃.用化學方程式表示這兩個反應①________________________②___________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CaCO3與稀鹽酸反應(放熱反應)生成CO2的量與反應時間的關系如右圖所示。下列結論不正確的是( )

A. 反應開始4 min內溫度對反應速率的影響比濃度大
B. 一段時間后,反應速率減小的原因是c(H+)減小
C. 反應在2~4 min內平均反應速率最大
D. 反應在2~4 min內生成CO2的平均反應速率為v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知如圖中H是無色液體,號稱生命之源,B是空氣中含量最多的物質,E是紅棕色氣體。
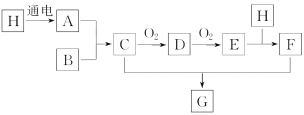
(1)C的化學式是___。
(2)D和E都是大氣污染物,D轉化成E的化學方程式是___。
(3)E和H的反應中,氧化劑和還原劑的質量比是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸乙酯是一種用途廣泛的精細化工產品。工業生產乙酸乙酯的方法很多,如圖:

下列說法正確的是
A. 反應①、②均是取代反應
B. 反應③、④的原子利用率均為100%
C. 與乙酸乙酯互為同分異構體的酯類化合物有2種
D. 乙醇、乙酸、乙酸乙酯三種無色液體可用Na2CO3溶液鑒別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醛(HCHO)在化工、醫藥、農藥等的方面有廣泛應用。
(1)甲醇脫氫法可制備甲醛(反應體系中各物質均為氣態),結合如圖圖像回答問題。
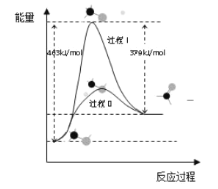
①此反應的熱化學方程式是______。
②反應活化能:過程I______過程II (填“>”“=”或“<”)
③過程II溫度—轉化率圖如圖,下列說法合理的是_____。
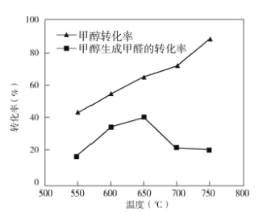
A.甲醇脫氫法制備甲醛過程無副反應發生
B.溫度高于650°C催化劑燒結,活性減弱
C.及時分離產品有利于提高甲醇生成甲醛的轉化率
(2)甲醛超標會危害人體健康,需對甲醛往行含量檢測及污染處理。
①某甲醛氣體傳感器的工作原理如圖所示,b極的電極反應式為_________
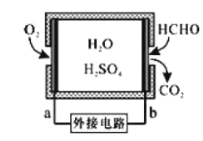
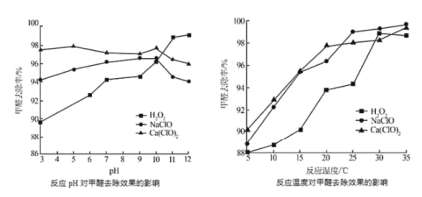
②氧化劑可處理甲醛污染,結合以如圖圖像分析春季(水溫約15℃)應急處理甲醛污染的水源應選擇的試劑為________。
(3)750K下,在恒容密閉容器中,充入的甲醇,發生反應:CH3OH(g)HCHO(g) + H2(g),若起始壓強為101kPa, 達到平衡轉化率為50.0%, 則反應平衡的常數Kp= ______。(用平衡分壓代替平衡農度計算,分壓=總壓×物質的量分數,忽略其它反應)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某油脂廠廢棄的油脂加氫鎳催化劑主要含金屬Ni、Al、Fe及其氧化物,還有少量其他不溶性物質。采用如下工藝流程回收其中的鎳制備硫酸鎳晶體(NiSO4·7H2O):
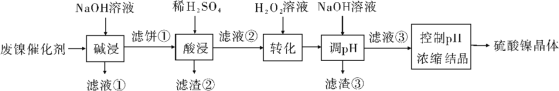
溶液中金屬離子開始沉淀和完全沉淀的pH如下表所示:
金屬離子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
開始沉淀時(c=0.01 mol·L1)的pH 沉淀完全時(c=1.0×105 mol·L1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列問題:
(1)“堿浸”中NaOH的兩個作用分別是______________。為回收金屬,用稀硫酸將“濾液①”調為中性,生成沉淀。寫出該反應的離子方程式______________。
(2)“濾液②”中含有的金屬離子是______________。
(3)“轉化”中可替代H2O2的物質是______________。若工藝流程改為先“調pH”后“轉化”,即
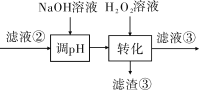
“濾液③”中可能含有的雜質離子為______________。
(4)利用上述表格數據,計算Ni(OH)2的Ksp=______________(列出計算式)。如果“轉化”后的溶液中Ni2+濃度為1.0 mol·L1,則“調pH”應控制的pH范圍是______________。
(5)硫酸鎳在強堿溶液中用NaClO氧化,可沉淀出能用作鎳鎘電池正極材料的NiOOH。寫出該反應的離子方程式______________。
(6)將分離出硫酸鎳晶體后的母液收集、循環使用,其意義是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯乙醛是基本有機合成原料之一,是生產農藥、醫藥的重要中間體。某化學興趣小組設計如圖所示裝置(夾持、加熱儀器略),模擬工業生產進行制備三氯乙醛(CCl3CHO)的實驗。
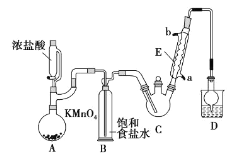
查閱資料,有關信息如下:
①制備反應原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能發生的副反應:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相關物質的相對分子質量及部分物理性質:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相對分子質量 | 46 | 147.5 | 163.5 | 64.5 |
熔點/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸點/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 與水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
回答下列問題:
(1)儀器E的名稱是____,冷凝水的流向是____口進水(填“a”或“b”)。
(2)有同學認為該裝置存在一處缺陷,應在BC之間加一干燥裝置,理由是____。
(3)該裝置C控制反應溫度在70℃左右,可采用____加熱的方法;
(4)裝置D干燥管的作用為____,裝置D燒杯中的試劑是____。
(5)反應結束后,從C中的混合物中分離出Cl3CCOOH的方法是(填名稱)____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氮化硼、氮化鋁、氮化鎵的結構類似于金剛石,熔點如表中所示:
物質 | BN | AIN | GaN |
熔點/℃ | 3000 | 2200 | 1700 |
試從結構的角度分析它們熔點不同的原因___________________________________。
(2)N、P、As位于同一主族,基態氮原子的核外共有________種不同運動狀態的電子,與PO43-互為等電子體的分子有________________(填一種即可)。
(3)鉻原子的最高能層符號是_______,其價電子軌道表示式為____________________。
(4)比較第二電離能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一種褐紅色晶體,吸濕性極強,易溶于水和乙醇,無論是固態、還是氣態,它都是以二聚體Au2Cl6的形式存在。寫出Au2Cl6的結構式__________________________.
(6)已知Zn2+、Au+均能與CN-形成配離子, Zn2+與CN-形成的配離子為正四面體形,Au+與CN-形成的配離子為直線形. 工業上常用Au+和CN-形成的配離子與Zn單質反應來提取Au單質,寫出該反應的離子方程式___________________________________________________________________________________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com