
【題目】[化學-—選修3:物質結構與性質]東晉《華陽國志南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品。回答下列問題:
(1)鎳元素基態原子的電子排布式為_________,3d能級上的未成對的電子數為______。
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液。
①[Ni(NH3)6]SO4中陰離子的立體構型是_____。
②在[Ni(NH3)6]2+中Ni2+與NH3之間形成的化學鍵稱為______,提供孤電子對的成鍵原子是_____。
③氨的沸點(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“極性”或“非極性”),中心原子的軌道雜化類型為_______。
(3)單質銅及鎳都是由______鍵形成的晶體:元素銅與鎳的第二電離能分別為:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某鎳白銅合金的立方晶胞結構如圖所示。

①晶胞中銅原子與鎳原子的數量比為_____。
②若合金的密度為dg/cm3,晶胞參數a=________nm。
【答案】37.( 1)1s22s22p63s23p63d84s2或[Ar] 3d84s2 2
(2)①正四面體
②配位鍵 N
③高于 NH3分子間可形成氫鍵極性 sp3
(3)金屬銅失去的是全充滿的3d10電子,鎳失去的是4s1電子
(4)①3:1
②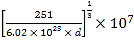
【解析】
試題分析:(1)鎳是28號元素,位于第四周期,第Ⅷ族,根據核外電子排布規則,其基態原子的電子排布式為1s22s2 2p63s23p63d84s2,3d能級有5個軌道,先占滿5個自旋方向相同的電子,剩余3個電子再分別占據三個軌道,電子自旋方向相反,所以未成對的電子數為2。
(2)①根據價層電子對互斥理論,SO42-的σ鍵電子對數等于4,孤電子對數為(6+2-2×4)÷2=0,則陰離子的立體構型是正四面體形。
②根據配位鍵的特點,在[Ni(NH3)6]2+中Ni2+與NH3之間形成的化學鍵稱為配位鍵,提供孤電子對的成鍵原子是N。
③氨分子間存在氫鍵,分子間作用力強,所以氨的沸點高于膦(PH3);根據價層電子對互斥理論,氨中心原子N的σ鍵電子對數等于3,孤電子對數為(5-3)÷2=1,則中心原子是sp3雜化,分子成三角錐形,正負電荷重心不重疊,氨是極性分子。
(3)銅和鎳屬于金屬,則單質銅及鎳都是由金屬鍵形成的晶體;銅失去的是全充滿的3d10電子,鎳失去的是4s1電子,所以ICu>INi。
(4)①根據均攤法計算,晶胞中銅原子個數為6×1/2=3,鎳原子的個數為8×1/8=1,則銅和鎳原子的數量比為3:1。
②根據上述分析,該晶胞的組成為Cu3Ni,若合金的密度為dg/cm3,根據ρ=m÷V,則晶胞參數a=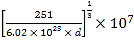 nm。
nm。


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案 全優沖刺100分系列答案
全優沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】為研究乙醇結構及其部分的化學性質,進行下列實驗。完成下列問題:
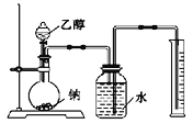
Ⅰ.用如圖裝置來推測乙醇的結構式。
(1)實驗中鈉需要粉碎成很小的顆粒,其原因是 _______________________________。
(2)兩次實驗平均用乙醇1.15g,收集到H2體積平均為0.28L(換算成標準狀態)。由實驗數據可推測H2來自乙醇分子中________(填名稱)的氫原子。
(3)盛裝乙醇的玻璃儀器是________________________
Ⅱ.利用下列裝置進行乙醇的催化氧化實驗,并檢驗其產物,其中C裝置的試管中盛有無水乙醇。(固定和夾持裝置已略去)
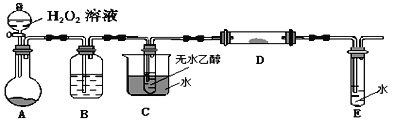
(4)裝置A圓底燒瓶內的固體物質是_____,B中的試劑是_____C的作用是______。
(5)本實驗中需要加熱的裝置有_________________ (填裝置下的字母)。
(6)寫出D處發生反應的化學方程式_________________________________。
(7)檢驗E中的生成物需要的試劑為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至過量,加入Ba(OH)2溶液的體積和所得沉淀的物質的量的關系如圖,下列說法不正確的是
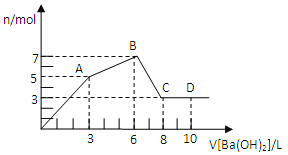
A. 原混合液中c(SO42-):c(Cl-)=1:1
B. 向D點溶液中通入C02氣體,立即產生白色沉淀
C. 圖中A點沉淀中含有BaSO4和Al(OH)3
D. AB段反應的離子方程式為:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某溫度時,反應CO(g)+ H2O(g)![]() CO2(g) + H2(g)的平衡常數k =1.0,該溫度下,向2L的密閉容器中充入2molCO和2mol水蒸氣,充分反應達到平衡狀態。
CO2(g) + H2(g)的平衡常數k =1.0,該溫度下,向2L的密閉容器中充入2molCO和2mol水蒸氣,充分反應達到平衡狀態。
(1)求平衡時CO2的濃度_____。
(2)求CO的轉化率_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在如圖所示裝置中,觀察到電流計指針偏轉,M棒變粗,N棒變細,其中P為電解質溶液。由此判斷M、N、P所代表的物質可能是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表與元素周期律在學習、研究和生產實踐中有很重要的作用。下表列出了12種元素在周期表中的位置。
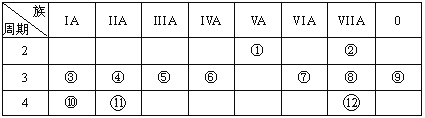
請回答:
(1)寫出下列元素名稱:①________,⑥________,⑦________。
(2)在①~元素中,金屬性最強的元素是___,非金屬性最強的素是____,最不活潑的元素是________。(均填元素符號)
(3)元素⑩與水反應的化學方程式__________________________。
(4)②與水的反應方程式______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列各組溶解度曲線圖,判斷分離提純方法。
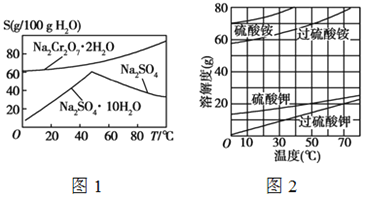
(1)根據圖1中Na2SO4和Na2SO4·10H2O的溶解度曲線(g/100 g水),由Na2SO4溶液得到Na2SO4固體的操作為:將溶液升溫結晶、 、用乙醇洗滌后干燥。用乙醇洗滌而不用水洗的原因是 。
(2)根據圖2所示相關物質的溶解度曲線。在實驗室中提純過硫酸鉀粗產品的實驗具體操作依次為:將過硫酸鉀粗產品溶于適量水中, ,干燥。
(3)根據圖1中紅礬鈉(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲線。從Na2Cr2O7和 Na2SO4的混合溶液中提取紅礬鈉的操作為:先將混合溶液蒸發濃縮,趁熱過濾。趁熱過濾的目的是 ;然后將濾液 ,從而析出紅礬鈉。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】經氯氣消毒的自來水,若用于配制以下溶液:①KOH②AgNO3③NaHCO3④FeCl2⑤NaHSO3⑥NaHS,會使配制的溶液變質的是
A.全部B.②④⑤⑥C.②⑤D.④⑥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com