
【題目】一定條件下,A、B、C三種氣體在絕熱密閉容器中隨反應進行,溫度升高;且各物質濃度的變化情況如圖所示,通過分析回答: 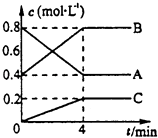
(1)寫出對應反應的化學方程式:;
(2)前4分鐘A的分解速率是;其轉化率是;
(3)4分鐘后保持其他條件不變,只改變下列條件,A的體積分數將(填“增大、減小、不變”)
①增大壓強:;
②降低溫度: .
【答案】
(1)2A?2B+C
(2)0.1 mol/(L?min);50%
(3)增大;減小
【解析】解:(1)由圖象可知,A的物質的量濃度減小,B和C的物質的量濃度增加,則A為反應物,B和C為生成物,由反應的濃度的變化之比等于化學計量數之比可得:△c(A):△c(B):△c(C)=0.4mol/L:0.4mol/L:0.2mol/L=2:2:1,則反應的化學方程式為:2A(g)2B(g)+C(g),
所以答案是:2A(g)2B(g)+C(g);
(2.)前4分鐘A的濃度變化=0.8mol/L﹣0.4mol/L=0.4mol/L,分解速率= ![]() =0.1 mol/(Lmin),A的轉化率=
=0.1 mol/(Lmin),A的轉化率= ![]() ×100%=50%,
×100%=50%,
所以答案是:0.1 mol/(Lmin); 50%;
(3.)①4分鐘后保持其他條件不變,增大壓強平衡向氣體體積減小的方向進行,A的體積分數將增大,所以答案是:增大;
②4分鐘后保持其他條件不變,反應為分解反應屬于吸熱反應,反應降低溫度平衡向放熱的方向進行,平衡逆向進行,A的體積分數將減小,所以答案是:減小.


科目:高中化學 來源: 題型:
【題目】法國里昂科學家最近發現一種只由四個中子構成的粒子,這種粒子稱為“四中子”,有人稱之為“零號元素”。有關“四中子”粒子說法不正確的是 ( )
A. 該粒子不顯電性 B. 在周期表中與氫元素占同一位置
C. 該粒子質量數為4 D. 一個該粒子質量比一個氫原子質量大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Fe與稀HNO3反應時,若兩者消耗物質的量之比為4:10,且生成Fe(NO3)2,則反應中生成的還原產物可能是( )
A.N2B.N2OC.NOD.N2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質反應時,改變反應條件或者反應物的物質的量之比,生成的產物不變的是( )
A.Na與氧氣 B.澄清石灰水與二氧化碳
C.氯化鋁溶液與氫氧化鈉溶液 D.Al與稀鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】節約能源、保護環境人人有責,請完成下列問題:
(1)垃圾的再生利用是垃圾資源化的最佳途徑,啤酒瓶等玻璃容器可_______;廢紙、廢塑料可_______。
(2)要使垃圾中寶貴的再生資源得到充分利用,必須對垃圾進行_______。
(3)塑料、合成橡膠等合成高分子材料都是用_______經過聚合反應制成的。在一定條件下,這些高分子材料又能解聚成_______,從而得到循環利用。
(4)如圖是垃圾箱上的標識:
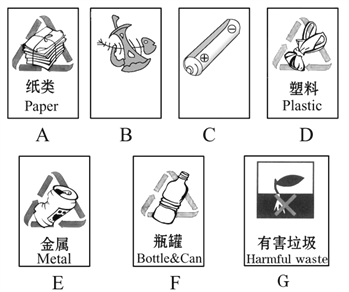
圖B和圖C的文字模糊不清,它們應分別表示____________和____________。
(5)垃圾處理的重要意義之一是控制環境污染,但在垃圾處理的過程中還要防止二次污染。下列處理垃圾的方法中有可能導致二次污染的是_______(填序號)。
①衛生填埋 ②堆肥 ③焚燒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于膠體的敘述中,不正確的是
A. 膠體可用于凈水,能吸附水中的懸浮物質而沉降
B. 濁液、膠體、溶液的本質區別是分散質粒子的直徑大小
C. 利用了丁達爾效應可以區別溶液和膠體
D. Fe(OH)3膠體不穩定,靜置后會有沉淀出現
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L恒容密閉容器中充入2 mol X和1mol Y發生反應:2X(g) +Y(g)![]() 3Z(g),反應過程持續升高溫度,測得X的體積分數與溫度的關系如圖所示。下列推斷正確的是 ( )
3Z(g),反應過程持續升高溫度,測得X的體積分數與溫度的關系如圖所示。下列推斷正確的是 ( )
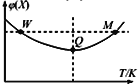
A. Q點時,Y的轉化率最大
B. 升高溫度,平衡常數增大
C. W點X的正反應速率等于M點X的正反應速率
D. 平衡時充入Z,達到新平衡時Z的體積分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水的電離平衡曲線如右圖所示,下列說法中不正確的是
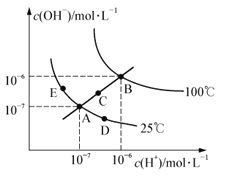
A.圖中五點的KW間的關系為:B>C>A=D=E
B.若從A點到D點,可采用:恒溫條件下,在水中加入少量的醋酸,提高溶液酸性
C.若從A點到C點,可采用:恒溫條件下,在水中加入少量的醋酸銨,促進水的電離
D.100℃時,將pH=2的硫酸與0.01mol·L-1的KOH溶液等體積混合后,溶液中c(H+)=c(OH-)=10-6mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com