
【題目】700℃時,向容積為2 L的恒容密閉容器中充入一定量的CO和H2,發生如下反應:
CO(g)+2H2(g)![]() CH3OH(g),反應過程中測定的部分數據見下表:
CH3OH(g),反應過程中測定的部分數據見下表:
反應時間/min | n(CO)/mol | n(H2)/ mol |
0 | 0.60 | 1.20 |
20 | 0.20 | |
30 | 0.40 |
下列說法正確的是
A. 反應在20 min內的平均速率為v(H2)=0.04 mol·L-1·min-1
B. 保持其他條件不變,升高溫度,平衡時c(CH3OH)= 0.15 mol·L-1,則反應的ΔH<0
C. 保持其他條件不變,再向平衡體系中同時通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,達到新平衡前v(正)> v(逆)
D. 相同溫度下,若起始時向容器中充入1.0 mol CH3OH,達到平衡時CH3OH轉化率大于1/3
【答案】BC
【解析】
由反應可知,30min時轉化的氫氣為0.8mol,則轉化的CO為0.4mol,則剩余的CO為0.6mol-0.4mol=0.2mol,可知20min時達到平衡,則
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
開始 0.6 1.2 0
轉化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.結合v=![]() 計算;
計算;
B.平衡時c(CH3OH)=0.2mol/L,升高溫度,平衡時c(CH3OH)=0.15 molL-1,可知升高溫度平衡逆向移動;
C.K=![]() =50,再向平衡體系中同時通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=
=50,再向平衡體系中同時通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=![]() =16.67<K,平衡正向移動;
=16.67<K,平衡正向移動;
D.若起始時向容器中充入1.0 mol CH3OH,設轉化的甲醇為x,K=![]() =0.02,
=0.02,
CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
開始 1.0 0 0
轉化 x x 2x
平衡 1-x x 2x
![]() =0.02,如x=
=0.02,如x=![]() 時,
時,![]() >0.02,則x<
>0.02,則x<![]() 時滿足題意。
時滿足題意。
由反應可知,30min時轉化的氫氣為0.8mol,則轉化的CO為0.4mol,則剩余的CO為0.6mol-0.4mol=0.2mol,可知20min時達到平衡,則
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
開始 0.6 1.2 0
轉化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.反應在20 min內的平均速率為v(H2)=![]() =0.02molL-1min-1,選項A錯誤;B.平衡時c(CH3OH)=0.2mol/L,升高溫度,平衡時c(CH3OH)=0.15 molL-1,可知升高溫度平衡逆向移動,則反應的△H<0,選項B正確;C.K=
=0.02molL-1min-1,選項A錯誤;B.平衡時c(CH3OH)=0.2mol/L,升高溫度,平衡時c(CH3OH)=0.15 molL-1,可知升高溫度平衡逆向移動,則反應的△H<0,選項B正確;C.K=![]() =50,再向平衡體系中同時通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=
=50,再向平衡體系中同時通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=![]() =16.67<K,平衡正向移動,則達到新平衡前v(正)>v(逆),選項C正確;D.若起始時向容器中充入1.0 mol CH3OH,設轉化的甲醇為x,K=
=16.67<K,平衡正向移動,則達到新平衡前v(正)>v(逆),選項C正確;D.若起始時向容器中充入1.0 mol CH3OH,設轉化的甲醇為x,K=![]() =0.02,
=0.02,
CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
開始 1.0 0 0
轉化 x x 2x
平衡 1-x x 2x
![]() =0.02,如x=
=0.02,如x=![]() 時,
時,![]() >0.02,則x<
>0.02,則x<![]() 時滿足題意,則達到平衡時CH3OH轉化率小于
時滿足題意,則達到平衡時CH3OH轉化率小于![]() ,選項D錯誤;答案選BC。
,選項D錯誤;答案選BC。


科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
①鋁和銅具有良好的導電性,所以電工操作時,可以把銅線和鋁線擰在一起
②汽車尾氣中含有能污染空氣的氮氧化物,主要是汽油燃燒不充分造成的
③從海水中提取物質都必須通過化學反應才能實現
④“遼寧艦”上用于艦載機降落攔阻索的特種鋼纜屬于新型無機非金屬材料
⑤明礬可以用于凈水,主要是由于Al3+水解生成的少量氫氧化鋁膠體有凈水作用
A.②③⑤ B.①②④ C.①③④⑤ D.①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某含氧有機化合物可以作為無鉛汽油的抗爆震劑,其相對分子質量為88.0,含C的質量分數為0.682,含H的質量分數為0.136,其余為O。
(1)試確定該化合物的分子式______。(寫出計算過程)
(2)經紅外光譜和核磁共振氫譜顯示該分子中有4個甲基。請寫出其結構簡式______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在通電條件下,用如圖所示裝置由乙二醛(OHC-CHO)制備乙二酸(H00C-COOH)。其制備反應為:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl。下列說法正確的是
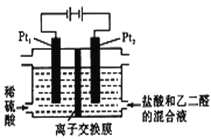
A. 每消耗0.1mol乙二醛在Pt1極放出2.24L氣體(標準狀況)
B. Pt1的電極反應為:4OH--4e-=2H2O+O2↑
C. 鹽酸是起提供Cl-和增強導電性的作用
D. 每得到lmol乙二酸將有2molH+從右室遷移到左室
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】肼是一種強還原劑,用NaClO與NH3反應可用于生產肼(N2H4),其反應的化學方程式為:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生產1000 g質量分數為25.6%的肼溶液最少需要___________L(標準狀況)NH3。
⑵工業次氯酸鈉溶液中含有氯酸鈉會影響所得肼的產品質量。測定次氯酸鈉樣品中的氯酸鈉含量的方法如下:取10.00 mL 堿性NaClO溶液試樣,加入過量H2O2,將次氯酸鈉完全還原(ClO3-在酸性條件下具有強氧化性,但堿性條件下幾乎無氧化性),加熱煮沸,冷卻至室溫,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亞鐵標準溶液30.00 mL,充分反應后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至終點(Cr2O72-被還原為Cr3+),消耗該溶液20.00 mL。
①用H2O2與次氯酸鈉反應的離子方程式為___________。
②實驗中加熱煮沸的目的是___________。
③計算樣品中NaClO3的含量(以g·L-1表示),寫出計算過程。___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用無機礦物資源生產部分材料的流程示意圖如下。下列說法正確的是( )
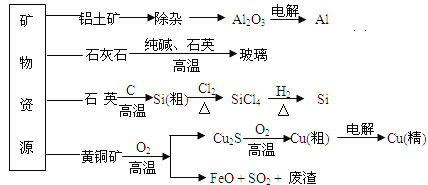
(注:鋁土礦中含有A12O3、SiO2、Fe2O3)
A. 在鋁土礦制備較高純度A1的過程中只用到NaOH溶液、CO2氣體、冰晶石
B. 石灰石、純堿、石英、玻璃都屬于鹽,都能與鹽酸反應
C. 在制粗硅時,氧化劑與還原劑的物質的量之比為1∶2
D. 黃銅礦(CuFeS2)與O2反應產生的Cu2S、SO2均是還原產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水是一個巨大的化學資源寶庫,利用海水可以獲得很多化工產品。
(1)海水中制得的氯化鈉可用于生產燒堿及氯氣。反應的離子方程式是______________。
(2)利用制鹽后的鹽鹵提取溴的工藝流程如下(部分操作和條件已略去):
![]()
將Br2與Na2CO3反應的化學方程式補充完整:_________
![]()
(3)鹽鹵蒸發冷卻后析出鹵塊的主要成分是MgCl2,此外還含Fe2+、Fe3+、Mn2+等離子。以鹵塊為原料制得鎂的工藝流程如下(部分操作和條件已略去):
生成氫氧化物沉淀的pH
物質 | 開始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步驟②中需控制pH=9.8,其目的是________________________________。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的離子反應方程式是______________________。
③步驟③需在HCl保護氣中加熱進行,請用化學平衡移動原理解釋原因________。
④NaClO還能除去鹽鹵中的CO(NH2)2,生成鹽和能參與大氣循環的物質。除去0.1mol CO(NH2)2時消耗NaClO_______g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在當下熱播的電視劇《人民的名義》中,達康書記正在參加省委召開的“開展垃圾分類,建設美麗廈門”擴大會議。達康書記問環保局長: 下列哪一組垃圾都是可回收垃圾
A. 果皮、舊報紙、廢電池 B. 剩飯、魚骨頭、玻璃瓶
C. 飲料瓶、玻璃酒瓶、廢作業本 D. 易拉罐、舊衣物、手機電池
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,通過下列反應可以制備特種陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是

選項 | x | y |
A | 壓強 | CO2與CO的物質的量之比 |
B | 溫度 | 容器內混合氣體的密度 |
C | MgSO4的質量(忽略體積) | CO的轉化率 |
D | SO2的濃度 | 平衡常數K |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com