
【題目】298 K、101kPa時,N2與H2反應過程中能量變化的曲線圖,下列敘述錯誤的是( )
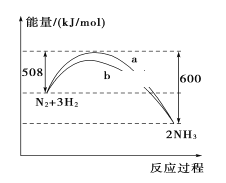
A. 加入催化劑,不能改變該化學反應的反應熱
B. b曲線是加入催化劑時的能量變化曲線
C. 該反應的熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常溫、體積一定的條件下,通入1 mol N2和3 mol H2,反應后放出的熱量為92 kJ
科目:高中化學 來源: 題型:
【題目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO與鎳反應會造成鎳催化劑中毒,為防止鎳催化劑中毒,工業上常用SO2將CO氧化,二氧化硫轉化為單質硫,則該反應的熱化學方程式為 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于銅晶體的堆積方式說法正確的是( )
A. 按ABABAB……方式堆積,配位數為12 B. 按ABABAB…方式堆積,配位數為8
C. 簡單立方堆積,配位數為6 D. 按ABCABC……方式堆積,配位數為12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數K值和溫度的關系如表:
溫 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表數據可知該反應的ΔH_____ 0(填填“>”、“=”或“<”)。
②下列措施能用勒夏特列原理解釋是_____(填序號)。
a.增大壓強有利于合成氨 b.使用合適的催化劑有利于快速生成氨
c.生產中需要升高溫度至500°C左右 d.需要使用過量的N2,提高H2轉化率
(2)0.2mol NH3溶于水后再與含有0.2mol H2SO4的稀溶液完全反應放熱Q kJ,請你用熱化學方程式表示其反應式:___________________________________。
(3)常溫時,將a mol氨氣溶于水后,再通入b mol氯化氫,溶液體積為1L,且c(NH4+)=c(Cl﹣),則一水合氨的電離平衡常數Kb=_____(用ab表示)。
(4)原料氣H2可通過反應 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 獲取,已知該反應中,當初始混合氣中的
CO(g)+3H2(g) 獲取,已知該反應中,當初始混合氣中的![]() 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如圖所示:
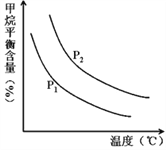
①圖中,兩條曲線表示壓強的關系是:P1_____P2(填“>”、“=”或“<”)。
②其它條件一定,升高溫度,氫氣的產率會______(填“增大”,“減小”減小,“不變”不變)。
(5)原料氣H2還可通過反應CO(g)+H2O(g)![]() CO2(g)+H2(g)獲取。
CO2(g)+H2(g)獲取。
①T℃時,向容積固定為5 L的容器中充入1mol H2O(g)和1mol CO, 反應達平衡后,測得CO的濃度0.08 mol/L,該溫度下反應的平衡常數K值為_____。
②保持溫度仍為T℃,容積體積為5L,改變水蒸氣和CO的初始物質的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態的是_____(填序號)。
a.容器內壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內生成a mol CO2的同時消耗a mol H2
d.混合氣中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在恒容密閉容器中,能表示反應X(g)+2Y(g) ![]() 2Z(g)一定達到化學平衡狀態的是( )
2Z(g)一定達到化學平衡狀態的是( )
①X、Y、Z的物質的量之比為1∶2∶2
②X、Y、Z的濃度不再發生變化
③容器中的壓強不再發生變化
④單位時間內生成n mol Z,同時生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丁苯酞(J)是治療輕、中度急性腦缺血的藥物,合成J的一種路線如下:
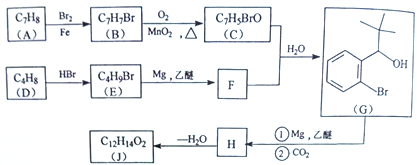
己知: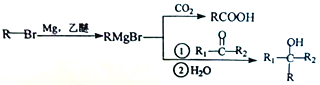
(1)G中官能團的名稱為_________、_________。
(2)D的系統命名是_________。
(3)由A生成B的化學方程式為_________,反應類型_________。
(4)C與銀氨溶液反應的化學方程式為________________________。
(5)H在一定條件下生成高分子化合物的結構簡式為_________。
(6)寫出一種同時滿足下面條件的G的同分異構體的結構簡式_________。
①核磁共振氫譜有4組峰②能與FeCl3溶液發生顯色反應
(7)借助題中信息寫出以乙醛和苯為原料,合成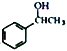 的路線流程圖(其它試劑自選)。_________________________________________________________。
的路線流程圖(其它試劑自選)。_________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,可逆反應X(s)+Y(g)![]() W(g)+Z(g)(正反應是放熱反應),在一定體積不變的容器中反應達到平衡后,改變條件,反應速率(v)隨時間變化的情況如圖所示。下列條件的改變與圖中情況相符的是( )
W(g)+Z(g)(正反應是放熱反應),在一定體積不變的容器中反應達到平衡后,改變條件,反應速率(v)隨時間變化的情況如圖所示。下列條件的改變與圖中情況相符的是( )

A. 增加了X的物質的量 B. 降低了溫度
C. 增大了壓強 D. 增大了Y的物質的量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式碳酸銅和氯氣都是用途廣泛的化工原料。
(1)工業上可用酸性刻蝕廢液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl)制備堿式碳酸銅,其制備過程如下:
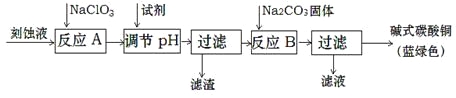
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物質 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
開始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸鈉的作用是 ;
②反應A后調節溶液的pH范圍應為 。
③第一次過濾得到的產品洗滌時,如何判斷已經洗凈? 。
④造成藍綠色產品中混有CuO雜質的原因是 。
(2)某學習小組在實驗室中利用下圖所示裝置制取氯氣并探究其性質。

①實驗室用二氧化錳和濃鹽酸加熱制取氯氣,所用儀器需要檢漏的有 。
②若C中品紅溶液褪色,能否證明氯氣與水反應的產物有漂白性,說明原因 。此時B裝置中發生反應的離子方程式是___________ _____。
③寫出A溶液中具有強氧化性微粒的化學式 。若向A溶液中加入NaHCO3粉末,會觀察到的現象是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com