
【題目】低溫脫硝技術可用于處理廢氣中的氮氧化物,發(fā)生的化學反應為:2NH3(g)+NO(g)+NO2(g) ![]() 2N2+3H2O(g) ΔH<0,在恒容的密閉容器中,下列有關說法正確的是 ( )
2N2+3H2O(g) ΔH<0,在恒容的密閉容器中,下列有關說法正確的是 ( )
A. 平衡時,其他條件不變,升高溫度可使該反應的平衡常數(shù)增大
B. 平衡時,其他條件不變,增加NH3的濃度,廢氣中氮氧化物的轉化率減小
C. 單位時間內消耗NO和N2的物質的量比為1∶2時,反應達到平衡
D. 其他條件不變,使用高效催化劑,廢氣中氮氧化物的轉化率增大
科目:高中化學 來源: 題型:
【題目】用電子式表示下列物質的結構:
(1)NH4Cl;
(2)Na2O2;
(3)CO2;
(4)MgCl2;(1)~(6)中,僅含離子鍵的是 , 僅含共價鍵的是 , 既有離子鍵又有共價鍵的是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,分別將四塊形狀相同、質量為7g 的鐵塊同時放入下列四種溶液中,產生H2速率最快的是( )
A.150mL 2mol·L-1的鹽酸B.500mL 2mol·L-1的硫酸
C.50mL 6mol·L-1的稀硝酸D.50mL 18.4mol·L-1的硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用鋅片、銅片和稀硫酸組成的原電池,下列說法錯誤的是( )
A.鋅為負極,銅為正極B.銅片上有氣泡冒出
C.鋅片上發(fā)生還原反應D.陽離子移向銅片
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定容積的密閉容器中進行反應;N2(g)+3H2(g)![]() 2NH3(g)。己知反應過程中某一時刻N2、H2、NH3的濃度分別為0.1mol/L、0.3mol/L、0.2mol/L。當反應達到平衡時,可能存在的數(shù)據(jù)是
2NH3(g)。己知反應過程中某一時刻N2、H2、NH3的濃度分別為0.1mol/L、0.3mol/L、0.2mol/L。當反應達到平衡時,可能存在的數(shù)據(jù)是
A. N2為0.2mol/L;H2為0.6mol/L B. N2為0.15mol/L
C. N2、H2均為0.18 mol/L D. NH3為0.4mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(l)在下列事實中,什么因素影響了化學反應的速率?
①熔融的KClO3放出氣泡很慢,撒入少量MnO2很快產生氣體______;
②同濃度、同體積的鹽酸中放入同樣大小的鋅粒和鎂粒,產生氣體有快有慢______;
③KI晶體和HgCl2晶體混合后無明顯現(xiàn)象,若一起投入水中,很快生成紅色HgI2______;
(2)某探究小組用測量HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。限選試劑:1.00 mol/LHNO3、2.00 mol/LHNO3,細顆粒大理石、粗顆粒大理石,35℃水浴。
①請根據(jù)能進行的探究內容,填寫以下實驗設計表,完成探究實驗:
實驗編號 | T℃ | 大理石規(guī)格 | HNO3濃度(mol/L) |
A | 常溫 | 2.00 | |
B | 粗顆粒 | 1.00 | |
C | 粗顆粒 | 2.00 | |
D | 細顆粒 | 2.00 |
②整個實驗中應控制的不變量是硝酸溶液體積和______。
③該實驗小組用如右圖實驗裝置進行實驗。

a.除電子天平、干燥管、錐形瓶、藥匙、膠塞等儀器外,必需的實驗儀器還有______。
b.若反應開始時電子天平讀數(shù)為100.00g,經2分鐘反應結束時的讀數(shù)為95.60g,則這兩分鐘內用CaCO3來表示的速率為_____g/min。
c.若撤除干燥管裝置,所測速率______(填“偏大”、“偏小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 1mol O的質量是16 g/mol B. Na+的摩爾質量是23 g
C. CO2的摩爾質量是44 g/mol D. 氫的摩爾質量是2 g/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探究某礦石(僅含兩種元素)的組成和性質,設計并完成如下實驗:
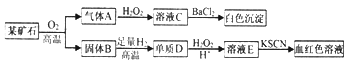
請回答:(1)某礦石的組成元素為__________(用元素符號表示)。
(2)氣體A與H2O2溶液反應的化學方程式是________________。
(3)寫出D→E的離子方程式____________________。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com