(16分)實驗室有一瓶Na
2SO
3固體,可能含有NaCl、Na
2SO
4、BaCl
2、K
2CO
3、K
2SO
4中的一種或幾種雜質,通過下列實驗確定該樣品的成分及Na
2SO
3的質量分數。請回答下列問題:
已知:
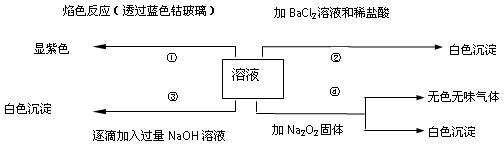
①取少量樣品于試管中,加水振蕩,未見沉淀生成:
②通過元素分析儀器的檢測,得知該樣品中不含K元素;
③用下圖所示儀器進行合理組裝,測定產生氣體的體積(SO
2在硫酸中的溶解忽略不計)
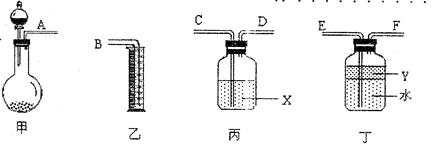
(1)按氣流從左到右方向,正確的連接順序為:A接____,
接
,
接B。
(2)利用所組裝置,由分液漏斗向燒瓶中滴加l0mL水,理論上將排入量筒中
mL液體。
(3)液體X是
,其作用是
。
(4)Y的作用是防止產生的氣體溶于水,下列歷給試劑符合要求的是____(填序號)。
A.甲苯 B.四氯化碳 C.酒精 D.濃硫酸
若稱取樣品3.00g,加入10.0mol/L的硫酸至過量(共5mL),產生無色氣體,排入量筒中液體的體積為229mL(已折算成標準下的狀況)。根據此信息,回答以下問題:
(5)對實驗獲得準確的氣體體積無益的操作有
(填序號)
①檢查裝置的氣密性:
②實驗結束后,將連通ZJ、丁的導管中的水也引入量筒;
③讀數時視線與量筒內凹液面最低相切點水平;
④恢復到室溫后再上下調整量筒位置,使乙、丁兩液面相平;
⑤在甲裝置膠塞上再連接一個導管,通入N
2將系統中SO
2全部排出。
(6)向充分逸出氣體后的溶液中加入過量BaCl
2溶液,得到白色沉淀13.98g。根據實驗所得現象及數據,可知:樣品中Na
2SO
3的質量分數是
,含有的雜質是
。