
【題目】磷酸氯喹在細胞水平上能有效抑制新型冠狀病毒2019-nCoV的感染。其中種以芳香化合物A 和乙酰乙酸乙酯(![]() )為原料合成磷酸氯喹的合成路線如圖:
)為原料合成磷酸氯喹的合成路線如圖:
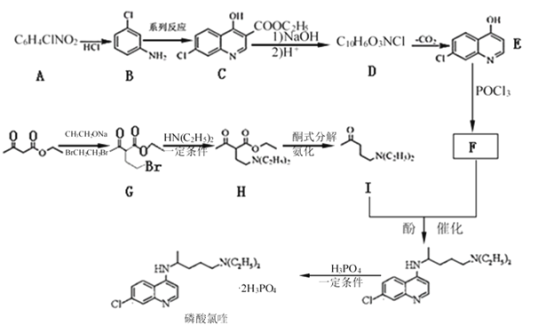
已知:①![]() 具有酸性
具有酸性
②![]()
![]()
![]()
③R1NH2+R2X![]() R1NHR2+HX(X表示鹵原子)。
R1NHR2+HX(X表示鹵原子)。
請回答下列問題:
(1) E中含氧官能團的名稱是________,G→H的反應類型是________。
(2)碳原子上連有4個不同的原子或基團時,該碳稱為手性碳。寫出B與足量的氫氣加成后的產物M的結構簡式,用星號(*)標出M中的手性碳_________。
(3) F的結構簡式是_______。
(4)寫出C與NaOH反應的化學方程式為___________。
(5) N是H的同分異構體,符合下列條件的N的同分異構體共有____種: 寫出其中一種核磁共振氫譜顯示環上只有3組峰,且峰面積之比為4:4:1的結構簡式________。
①含有基團![]() 、-N(C2H5)2
、-N(C2H5)2
②酸性水解產物中含有乙酸
③能與金屬鈉反應生成H2
(6)參照上述信息和合成路線,請設計以苯和1,4 -丁二醇為原料合成![]() 的合成路線(無機試劑任選)____________。
的合成路線(無機試劑任選)____________。
【答案】羥基 取代 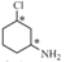
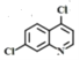
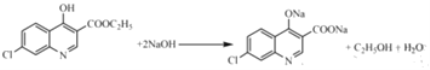 19
19 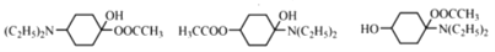 (任寫一種)
(任寫一種) 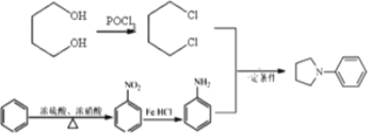
【解析】
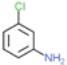
根據已知信息②,在Fe/HCl的條件下-NO2發生還原轉化為-NH2,B為間氨基氯苯,則A為間硝基氯苯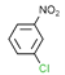 ;C中含有酚羥基與氫氧化鈉發生酸堿中和,含有酯基發生堿性條件的水解,苯環上的氯原子性質穩定需要一定壓強下可以水解,常溫不與氫氧化鈉反應,酸化后可以得到D
;C中含有酚羥基與氫氧化鈉發生酸堿中和,含有酯基發生堿性條件的水解,苯環上的氯原子性質穩定需要一定壓強下可以水解,常溫不與氫氧化鈉反應,酸化后可以得到D ,D經脫羧反應(-CO2)生成E,I和F發生信息③的反應,可知E結構中羥基被取代為氯原子,則F為
,D經脫羧反應(-CO2)生成E,I和F發生信息③的反應,可知E結構中羥基被取代為氯原子,則F為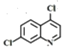 ;乙酰乙酸乙酯在乙醇鈉的作用下與1,2-二溴乙烷發生取代反應,生成HBr和G,G與HN(C2H5)2在一定條件下取代反應(參考信息③),生成HBr和H,以此作答。
;乙酰乙酸乙酯在乙醇鈉的作用下與1,2-二溴乙烷發生取代反應,生成HBr和G,G與HN(C2H5)2在一定條件下取代反應(參考信息③),生成HBr和H,以此作答。
(1) E中含氧官能團的名稱是羥基;參考已知信息③,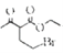 與HN(C2H5)2在一定條件下生成和
與HN(C2H5)2在一定條件下生成和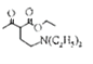 和HBr,故G→H的反應類型是取代反應;
和HBr,故G→H的反應類型是取代反應;
(2) 與足量的氫氣加成后的產物M為
與足量的氫氣加成后的產物M為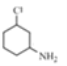 ,連接Cl原子的碳、連接N原子的碳均連接了四個不同基團,故為手性碳原子,可表示為
,連接Cl原子的碳、連接N原子的碳均連接了四個不同基團,故為手性碳原子,可表示為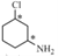 ;
;
(3)根據分析,F的結構簡式是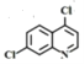 ;
;
(4)根據分析,C中含有酚羥基與NaOH發生酸堿中和,含有酯基在堿性條件下發生水解生成羧酸鹽和乙醇,苯環上的氯原子穩定,需要在一定壓強下才能反應,故C與NaOH反應的化學方程式為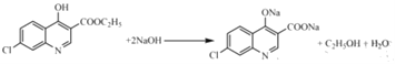 ;
;
(5)H的同分異構體N能水解且酸性水解產物含有乙酸,說明分子內含有CH3COO-,能與金屬鈉反應生成氫氣,說明含有-OH,另已知分子含有含有![]() 和-N(C2H5)2;若CH3COO-、-OH、-N(C2H5)2連接
和-N(C2H5)2;若CH3COO-、-OH、-N(C2H5)2連接![]() 的不同碳原子上,同分異構體有10種(類似于苯環上ABC的10種結構);若兩兩基團連接相同碳原子(三種基團兩兩組合有三種情況),另外一個基團可以鄰間對放置,則可得到9種同分異構體;根據上述分析符合條件的N的同分異構體共19種; 其中核磁共振氫譜顯示環上只有3組峰,且峰面積之比為4:4:1,根據要求應該在兩兩組合中對位結構,故結構簡式為
的不同碳原子上,同分異構體有10種(類似于苯環上ABC的10種結構);若兩兩基團連接相同碳原子(三種基團兩兩組合有三種情況),另外一個基團可以鄰間對放置,則可得到9種同分異構體;根據上述分析符合條件的N的同分異構體共19種; 其中核磁共振氫譜顯示環上只有3組峰,且峰面積之比為4:4:1,根據要求應該在兩兩組合中對位結構,故結構簡式為![]() (任寫一種);
(任寫一種);
(6)根據產物結構分析,出現R1NR2R3需要運用信息③R1NH2+R2X![]() R1NHR2+HX,可知R1代表苯環,R2R3代表環狀結構,需要在苯環上發生硝化反應,再被還原得苯胺,R2R3需要出現鹵素原子,根據信息采用POCl3引入兩個氯原子,然后發生類似于信息③反應進行合成,則路線為
R1NHR2+HX,可知R1代表苯環,R2R3代表環狀結構,需要在苯環上發生硝化反應,再被還原得苯胺,R2R3需要出現鹵素原子,根據信息采用POCl3引入兩個氯原子,然后發生類似于信息③反應進行合成,則路線為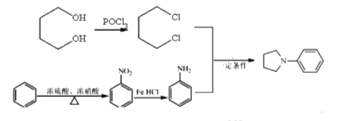 。
。


科目:高中化學 來源: 題型:
【題目】用11.92gNaClO配成溶液,向其中加入0.01molNa2SX恰好完全反應,生成Na2SO4和NaCl。則Na2SX 中的 x=__________(寫出簡要計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯巴比妥是鎮靜、安眠類藥物,其合成路線如下:
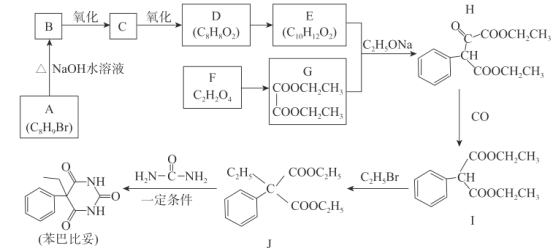
請回答下列問題:
(1)G的化學名稱為_________,C的分子式為__________。
(2)F+X→G+ H2O,X的結構簡式為____________。
(3)H中含有的官能團名稱為__________,I→J的反應類型為______________。
(4)同時滿足下列條件的E的同分異構體共有______種。
①含有苯環且苯環上有兩個取代基
②能發生水解反應且能發生銀鏡反應
(5)化合物J→苯巴比妥的化學方程式為________________________________。
(6)以1,3-丁二烯、乙醇和尿素(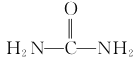 )為原料合成
)為原料合成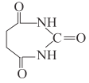 所需無機試劑任選,請寫出流程:_____________________________
所需無機試劑任選,請寫出流程:_____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著世界工業經濟的發展、人口的劇增,全球能源緊張及世界氣候面臨越來越嚴重的問題,如何降低大氣中CO2的含量及有效地開發利用CO2引起了全世界的普遍重視。
(1)甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液態甲醇完全燃燒放熱22.68 kJ,寫出甲醇燃燒熱的熱化學方程式:_________________。
(2)金屬鈦冶煉過程中其中一步反應是將原料金紅石轉化:
TiO2(金紅石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
則TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于凈化空氣,飲用水消毒,處理工業廢物和作為漂白劑。臭氧幾乎可與除鉑、金、銥、氟以外的所有單質反應如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,則O3轉化為O2的熱化學方程式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究CO和CO2的利用對促進低碳社會的構建具有重要意義。請回答下列問題:
(1)利用CO和H2在一定條件下可合成甲醇,發生反應: CO(g)+ 2H2(g)![]() CH3OH(g),其兩種反應過程中能量的變化曲線如圖中a、b所示,下列說法正確的是_____(填字母)。
CH3OH(g),其兩種反應過程中能量的變化曲線如圖中a、b所示,下列說法正確的是_____(填字母)。
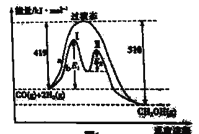
A.上述反應的△H= -91 kJ·mol-1
B.該反應自發進行的條件為高溫
C. b過程使用催化劑后降低了反應的活化能和H
D. b過程的反應速率:第Ⅱ階段>第Ⅰ階段
(2)若反應CO(g)+2H2(g)![]() CH3OH(g)在溫度不變且體積恒定為1L密閉容器中發生,反應過程中各物質的物質的量隨時間變化見表所示:
CH3OH(g)在溫度不變且體積恒定為1L密閉容器中發生,反應過程中各物質的物質的量隨時間變化見表所示:
時間/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各項能作為判斷該反應達到平衡標志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO與CH3OH的物質的量之比保持不變
C.混合氣的平均相對分子質量保持不變
D.混合氣體的密度保持不變
②若起始壓強為P0kPa,反應速率若用單位時間內分壓的變化表示,則10 min內H2的反應速率v(H2)=_____kPa/min;該溫度下反應的平衡常數Kp=______。(分壓=總壓×物質的量分數)。
(3)甲和乙兩個恒容密閉容器的體積相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,測得不同溫度下CO的平衡轉化率如圖所示,則L、M兩點容器內平衡常數:K(M)_____ K(L); 壓強:p(M)__2p(L)。(填“>”“<”或“=”)

(4)以納米二氧化鈦為工作電極,稀硫酸為電解質溶液,在一定條件下通入CO2進行電解,在陰極可制得低密度聚乙烯(![]() )。電解時,陰極的電極反應式是_________。
)。電解時,陰極的電極反應式是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠廢金屬屑的主要成分為Cu、Fe和Al,此外還含有少量Al2O3和Fe2O3,為探索工業廢料的再利用,某化學興趣小組設計了如下實驗流程,用該工廠的金屬廢料制取氯化鋁、綠礬晶體(FeSO4·7H2O)和膽礬晶體。
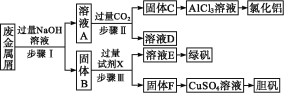
完成下列填空:
(1)寫出步驟Ⅰ反應的離子方程式:___。
(2)試劑X是___,溶液D是___。
(3)在步驟Ⅱ中,用如圖裝置制取CO2并通入溶液A中。一段時間后,仍觀察不到燒杯中產生白色沉淀。為了固體C的生成,在藥品和裝置上可采取的改進措施是___。
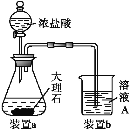
(4)溶液E中加入KSCN溶液無明顯現象,表明濾液中不存在Fe3+,用離子方程式解釋其可能的原因:___。
(5)將固體F繼續加入熱的稀硫酸,同時不斷鼓入空氣,固體溶解得CuSO4溶液,寫出反應的化學方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今年是門捷列夫發現元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z為短周期主族元素,W與X的最高化合價之和為8。下列說法錯誤的是

A. 原子半徑:W<X
B. 常溫常壓下,Y單質為固態
C. 氣態氫化物熱穩定性:Z<W
D. X的最高價氧化物的水化物是強堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.石墨晶體呈層狀結構,每個碳原子只有3個價電子形成共價鍵
B.白磷是正四面體分子,鍵角是109°28’,1摩爾白磷含共價鍵6NA個
C.臭氧是直線型分子,等質量的臭氧和氧氣所含的氧原子數相同
D.S8是分子晶體,8個硫原子形成環狀結構,摩爾質量為256g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的幾種離子,已知各離子的濃度均相等,進行如下實驗:
中的幾種離子,已知各離子的濃度均相等,進行如下實驗:
![]() 取少量該溶液,加入足量稀硫酸,無明顯現象。
取少量該溶液,加入足量稀硫酸,無明顯現象。
![]() 取
取![]() 反應后的溶液,加入足量濃NaOH溶液,最終得到紅褐色沉淀,并伴有刺激性氣味氣體產生。下列說法不正確的是
反應后的溶液,加入足量濃NaOH溶液,最終得到紅褐色沉淀,并伴有刺激性氣味氣體產生。下列說法不正確的是![]()
![]()
A.該溶液中肯定不存在![]() 、
、![]() 、
、![]()
B.另取該溶液,加入適量氯水和淀粉溶液,若溶液顯藍色,即可確定該溶液中一定不含![]()
C.取原溶液進行焰色反應,顯黃色,則溶液中一定含有的離子有六種
D.該溶液中肯定存在![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com