
【題目】如圖所示,組成原電池,回答下列問題。
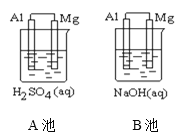
(1)該裝置是把___________ 能轉化為_________能的裝置。
(2)A池中Mg電極是__________(填“正”或“負”)極,其在反應中_____(填“得到”或“失去”)電子,該極發生的反應是__________(填“氧化”或“還原”)反應,其電極反應為________________________,該裝置中電流的方向是由_____到 ______。
(3)B池中負極材料是_________,該裝置中電子的移動方向是由_____到 ______。
【答案】化學 電 負 失去 氧化 Mg—2e—=Mg2+ Al Mg Al Al Mg
【解析】
(1)原電池把化學能轉化為電能;
(2)原電池中活潑金屬做負極,負極失電子發生氧化反應;原電池中電流由正極經導線流向負極;
(3)B池中鋁與氫氧化鈉溶液反應,鋁失電子發生氧化反應,鋁是負極、鎂是正極。原電池中電子由負極經導線流向正極。
(1)該裝置為原電池是把化學能轉化為電能的裝置;
(2)鎂的活潑性大于鋁,A池中Mg電極是負極,Mg在反應中失去電子,發生氧化反應,其電極反應為Mg—2e—=Mg2+,原電池中電流由正極經導線流向負極,該裝置中電流的方向是由Al到 Mg。
(3)B池中鋁與氫氧化鈉溶液反應,鋁失電子發生氧化反應,Al是負極、Mg是正極。原電池中電子由負極經導線流向正極,電子的移動方向是由Al到 Mg。


科目:高中化學 來源: 題型:
【題目】下列關于苯和乙烯的敘述中正確的是( )
A.兩者都容易發生取代反應
B.兩者都可以與溴水發生加成反應
C.兩者分子中所有原子都在同一平面內
D.兩者都含有碳碳雙鍵,能與酸性KMnO4溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子在相應的條件下可能大量共存的是( )
A. 能使pH試紙變紅的溶液中:CO![]() 、K+、Cl-、Na+
、K+、Cl-、Na+
B. 由水電離產生的c(OH-)=1×10-10mol·L-1的溶液中:NO![]() 、Mg2+、Na+、SO
、Mg2+、Na+、SO![]()
C. 在![]() =1×1012的溶液中:NH
=1×1012的溶液中:NH![]() 、Fe2+、Cl-、NO
、Fe2+、Cl-、NO![]()
D. ![]() =10-14mol·L-1的溶液中:Na+、HCO
=10-14mol·L-1的溶液中:Na+、HCO![]() 、Cl-、K+
、Cl-、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于化學鍵的說法,正確的是( )
A.構成單質的分子中一定含有共價鍵
B.由非金屬元素組成的化合物可能是離子化合物
C.非極性鍵只存在單質分子里
D.不同元素組成的多原子分子里的化學鍵一定是極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環境中常見的重金屬污染物有汞、鉛、錳、鉻、鎘。處理工業廢水中含有的![]() 和
和![]() 常用的方法是還原沉淀法,該法的工藝流程為
常用的方法是還原沉淀法,該法的工藝流程為![]()
![]()
![]()
![]() Cr3+
Cr3+![]() Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2![]() (黃色)+2H+
(黃色)+2H+![]()
![]() (橙色)+H2O。
(橙色)+H2O。
(1)寫出第①步反應的平衡常數表達式:_________________________________。
(2)關于第①步反應,下列說法正確的是________(填序號)。
A.通過測定溶液的pH可以判斷反應是否已達到平衡狀態
B.該反應為氧化還原反應
C.在強酸性環境下,溶液的顏色為橙色
(3)第②步反應中,還原0.1 mol![]() ,需要________mol FeSO4·7H2O。
,需要________mol FeSO4·7H2O。
(4)第③步反應除生成Cr(OH)3沉淀外,還可能生成的沉淀為________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常溫下,Cr(OH)3的溶度積常數Ksp=10-32,當溶液中Cr3+的濃度降至10-5mol·L-1,認為Cr3+已經完全沉淀。現將第③步反應后溶液的pH調至4,請通過計算說明Cr3+是否沉淀完全(請寫出計算過程)。____________
Cr3+(aq)+3OH-(aq)。常溫下,Cr(OH)3的溶度積常數Ksp=10-32,當溶液中Cr3+的濃度降至10-5mol·L-1,認為Cr3+已經完全沉淀。現將第③步反應后溶液的pH調至4,請通過計算說明Cr3+是否沉淀完全(請寫出計算過程)。____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖裝置電解硫酸鉀溶液制取氫氣,氧氣,硫酸和氫氧化鉀。從開始通電時,收集B和C逸出的氣體。1 min后測得B口的氣體體積為C口處的一半,下列說法不正確的是
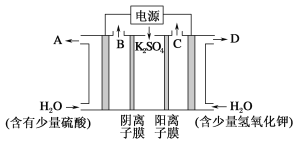
A. 電源左側為正極
B. 電解槽左側的電極反應方程式為2H2O-4e-==O2↑+4H+
C. D口導出的溶液為KOH溶液,且濃度比剛加入電解槽右側時的濃度大
D. 標準狀況下,若1 min后從C口處收集到的氣體比B口處收集到的氣體多2.24 L,則有0.1NA個SO42-通過陰離子膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上通過電解MnSO4和ZnSO4制取Zn和MnO2,原料為軟錳礦和閃鋅礦。軟錳礦主要含有MnO2(約70%)、SiO2、Al2O3,閃鋅礦主要含有ZnS(約80%)、FeS、CuS、SiO2。
I.(1)為了測量軟錳礦中MnO2含量的測定,現將14.5g軟錳礦溶于足量的稀硫酸中,加入足量的碘化鉀晶體,充分反應后,過濾,將濾液加水稀釋至1L,取25.00ml該溶液于錐形瓶中,滴入幾滴淀粉溶液作指示劑,用0.1000mol·L﹣1的標準Na2S2O3溶液滴定,消耗標準液50.00ml,則軟錳礦中MnO2含量____。(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣)
Ⅱ.研人員開發了綜合利用這兩種資源的同槽酸浸工藝,工藝流程如圖所示。請回答下列問題:
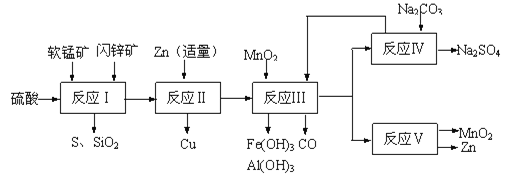
(2)反應Ⅰ后過濾所得濾液中含有有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金屬陽離子。試寫出反應Ⅰ中生成CuSO4的化學方程式____________。
(3)若反成Ⅱ加入的鋅過量,還會進一步發生反應的離子方程式為_________。
(4)反應Ⅲ中加入MnO2的作用是(離子方程式表示)______________________。
(5)反應Ⅴ的條件是電解,電解時均用惰性電極,陽極發生的電極反應可表示為__________。
(6)圖是Na2SO4和Na2SO4·10H2O的溶解度曲線(g/100g水),則Ⅳ中得到Na2SO4固體的操作是:將分離出MnCO3和ZnCO3后的濾液升溫結晶→___→用乙醇洗滌→干燥.用乙醇洗滌而不用水洗的原因是___________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,表中所列的字母分別代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高價氧化物對應水化物的電子式為__________。
(2)R是由表中已標出的A~F 中某三種元素組成的化合物,是常見家用消毒劑的主要成分,其化學名稱為_____________;Na2FeO4是工業常用的消毒劑,利用R 制備Na2FeO4的原理如下,請補齊缺少的物質,并配平反應方程式的系數:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)氣態氫化物沸點:D _____ E;元素形成的簡單離子的半徑:A _____ D(填“>”,“<”或“=”)
(4)E 的某種氧化物通入F 單質的水溶液中,并不能增大F 單質水溶液的漂白性,請結合方程式說明______________________________________________________________。
(5)由表中未標出的某種金屬元素的單質G ,可以發生如圖所示的轉化:
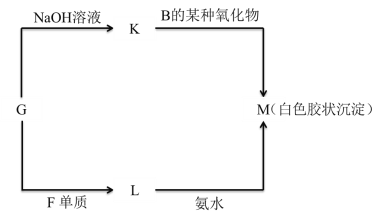
①寫出 G 轉化為 K 的化學方程式________________________________________。
②寫出 L 轉化為 M 的離子方程式________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 lmol碳完全燃燒后可放出393.5KJ的熱量,下列熱化學方程式正確的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com