
【題目】膽礬是配制波爾多液的主要原料,常用在樹木,花卉的保護上。
(1)基態銅原子的電子排布式為___________。
(2)乙烯氨氧化可以得到丙烯腈(CH2=CH-CN),丙烯腈中各元素的電負性由大到小順序為____________,1mol丙烯腈分子中含有π鍵數目為_________。
(3)CN-與N2互為等電子體,寫出CN-的電子式______________。
(4)通過X射線衍射發現,膽礬中存在SO42-離子,SO42-離子的VSEPR構型名稱為___________,CO32-中心原子的雜化形式為________。
(5)硫酸銅灼燒可以生成一種紅色晶體,其結構如圖所示為體心立方晶胞,則該化合物的化學式是______;若該晶體中距離最近的銅原子與氧原子直接距離為acm,則晶體密度表達式為_____g/cm3。

【答案】 1s22s22p63s23p63d104s1 N>C>H 3NA [:C┇┇N:]- 正四面體 sp2 Cu2O 
【解析】(1)銅的原子序數是29,基態銅原子的電子排布式為1s22s22p63s23p63d104s1。(2)非金屬性越強,電負性越大,則丙烯腈中各元素的電負性由大到小順序為N>C>H;雙鍵中含有1個π鍵,三鍵中含有2個π鍵,則1mol丙烯腈分子中含有π鍵數目為3NA。(3)CN-與N2互為等電子體,互為等電子體的微粒結構相似,則CN-的電子式為![]() 。(4)SO42-離子中中心原子S原子含有的價層電子對數是4,則SO42-離子的VSEPR構型名稱為正四面體;CO32-中中心原子碳原子的價層電子對數是
。(4)SO42-離子中中心原子S原子含有的價層電子對數是4,則SO42-離子的VSEPR構型名稱為正四面體;CO32-中中心原子碳原子的價層電子對數是![]() ,不存在孤對電子,則碳原子的雜化形式為sp2。(5)晶胞中銅原子全部在晶胞內,共計4個,氧原子個數是1+8×1/8=2,所以該化合物的化學式是Cu2O;若該晶體中距離最近的銅原子與氧原子直接距離為acm,則體對角線是4a cm,邊長是
,不存在孤對電子,則碳原子的雜化形式為sp2。(5)晶胞中銅原子全部在晶胞內,共計4個,氧原子個數是1+8×1/8=2,所以該化合物的化學式是Cu2O;若該晶體中距離最近的銅原子與氧原子直接距離為acm,則體對角線是4a cm,邊長是![]() ,所以晶體密度表達式為
,所以晶體密度表達式為 。
。


科目:高中化學 來源: 題型:
【題目】下列我國科技成果所涉及物質的應用中,發生的不是化學變化的是
|
|
|
|
A.甲醇低溫所制氫氣用于新能源汽車 | B.氘、氚用作“人造太陽”核聚變燃料 | C.偏二甲肼用作發射“天宮二號”的火箭燃料 | D.開采可燃冰,將其作為能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是學習物質結構和性質的重要工具,下圖是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分別代表某種化學元素。請依據這9種元素回答下列問題。
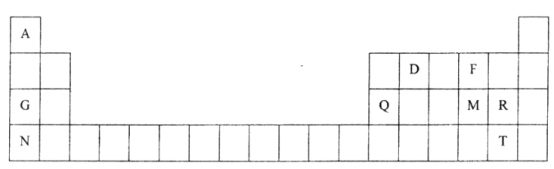
(1)以上9種元素中金屬性最強的元素是_______(填元素符號)。
(2)元素的非金屬性:M______R(填“>”或“<”)。
(3)R的最高價氧化物對應水化物的化學式是_____________。
(4)F、G兩元素形成的淡黃色固體物質的電子式為_____________。
(5)表中M、R、N元素可形成與Ar具有相同電子層結構的簡單離子,這些離子的半徑由大到小的順序是_____________(用離子符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下VL氨氣溶解在1L水中,所得溶液的密度為ρ g·mL-1,質量分數為ω,物質濃度為c mol·L1,則下列關系中正確的是( )
A. c=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D. ρ=
D. ρ=![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用1L1molL﹣1NaOH溶液吸收0.6molCO2 , 所得溶液中Na2CO3和NaHCO3的物質的量之比約為( )
A.2:3
B.1:2
C.2:1
D.3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】填空
(1)氯原子的結構示意圖為_____________________。
(2)![]() 微粒中的質子數是_______,中子數是_______,核外電子數是_______。
微粒中的質子數是_______,中子數是_______,核外電子數是_______。
(3)49g硫酸的物質的量為________mol,其完全電離產生H+的個數為___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,則溶液中Al3+的物質的量濃度_________;SO42— 物質的量濃度__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組通過下列反應原理制備SO2并進行性質探究。反應原理為:Na2SO3(固)+H2SO4(濃)= Na2SO4 + SO2↑+ H2O

(1)根據上述原理制備并收集干燥SO2的實驗裝置連接順序為________________。(填接頭序號)
(2)D中盛裝的試劑為_________________。
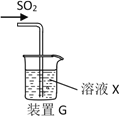
(3)甲同學用注射器吸取純凈的SO2并結合裝置G進行SO2的性質實驗,若X是Na2S溶液,其目的是檢驗SO2的_____________,可觀察到的現象_________ 。
(4)實驗1:乙同學將溶液X換為濃度均為0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已經除去溶解氧),通入少量SO2后觀察到燒杯產生白色沉淀,乙同學認為白色沉淀為BaSO4,為探究白色沉淀的成因,他繼續進行如下實驗驗證:(已知:0.1mol/L Fe(NO3) 3的pH=2)
實驗 | 操作 | 現象 | 結論和解釋 |
2 | 將SO2通入0.1mol/L ____和BaCl2混合液 | 產生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 將SO2通入_______ 和 BaCl2混合液 | 產生白色沉淀 | 酸性條件NO3-能將H2SO3氧化為SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海水得到的粗食鹽水中常含Ca2+、Mg2+、SO42—![]() ,需要分離提純。現有含少量CaCl2、MgSO4的粗食鹽水,在除去懸浮物和泥沙之后,要用4種試劑:①鹽酸、②Na2CO3、③NaOH、④BaCl2來除去食鹽水中的Ca2+、Mg2+、SO42—
,需要分離提純。現有含少量CaCl2、MgSO4的粗食鹽水,在除去懸浮物和泥沙之后,要用4種試劑:①鹽酸、②Na2CO3、③NaOH、④BaCl2來除去食鹽水中的Ca2+、Mg2+、SO42—![]() 。提純時的操作步驟和加入試劑的情況如圖。
。提純時的操作步驟和加入試劑的情況如圖。

圖中a、b、c、d分別表示上述4種試劑中的一種,請回答:
(1)沉淀A的名稱是________。
(2)試劑d是________;判斷試劑d已經足量的方法是____________________。
(3)加入b、c后溶液中發生的化學反應的化學方程式有__________________________(任寫兩個)。
(4)現有下列儀器,過濾出沉淀A、B、C時必須用到的是____(填序號),儀器③的名稱是______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向甲、乙兩個容積均為1L的恒容容器中分別充入2molA、2molB和1molA、1molB。相同條件下發生如下反應:A(g)+B(g) ![]() xC(g) △H<0.測得兩容器中c(A)隨時間t的變化如圖所示。下列說法錯誤的是:
xC(g) △H<0.測得兩容器中c(A)隨時間t的變化如圖所示。下列說法錯誤的是:

A. x可能等于2也可能等于3
B. 若向平衡后的乙容器充入C,則再次達到平衡時A的體積分數減小
C. 若升高甲容器的溫度,可使甲容器中各物質的體積分數與乙容器相同
D. 若其它條件不變,使乙容器體積變為2L,則平衡時乙容器中:0.25mol/L<c(A)<0.5mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com