
【題目】以甲醇為燃料的新型電池,其成本大大低于以氫氣為燃料的傳統燃料電池,目前得到廣泛的研究,如圖是目前研究較多的一類固體氧化物燃料電池工作原理示意圖。回答下列問題:

(1)B極上的電極反應式為 。
(2)若用該燃料電池做電源,用石墨做電極電解硫酸銅溶液,當陽極收集到11.2L(標準狀況)氣體時,消耗甲醇的質量為 克,若要使溶液復原,可向電解后的溶液中加入的物質有 。
(3)目前已開發出用電解法制取ClO2的新工藝。

①上圖示意用石墨做電極,在一定條件下電解飽和食鹽水制取ClO2。若用上述甲醇燃料電池進行電解,則電解池的電極a接甲醇燃料電池的 極( 填A或B) ,寫出陽極產生ClO2的電極反應式:__________。
②電解一段時間,當陰極產生的氣體體積為112 mL(標準狀況)時,停止電解。通過陽離子交換膜的陽離子的物質的量為_________mol。
【答案】
(1)CH3OH-6e-+O2- =CO2+4H+
(2)10.67 CuO或CuCO3
(3)①A 2H2O+Cl--5e-=ClO2+4H+ ②0.01
【解析】
試題分析:
(1)燃料電池中負極通燃料,發生氧化反應,正極通氧氣,發生還原反應。所以負極上甲醇失去電子結合氧離子形成二氧化碳和水,正極上氧氣得到電子形成氧負離子。則負極B極上的電極反應式為CH3OH-6e-+O2- =CO2+4H+。
(2)用石墨做電極電解硫酸銅溶液時,陽極電極反應為:4OH--4e-= O2 + 2H2O;當陽極收集到11.2L(標準狀況)氣體時,即0.5mol O2,需轉移電子2mol。1mol 甲醇反應轉移6mol電子,則消耗甲醇的質量為![]() mol×32g/mol=10.67g。若要使溶液復原,可向電解后的溶液中加入CuO或CuCO3。
mol×32g/mol=10.67g。若要使溶液復原,可向電解后的溶液中加入CuO或CuCO3。
(3)①示意圖中Na+從左到右,則可判斷電極a為陽極,需接電源的正極,即接甲醇燃料電池的A極。該裝置的目的是制備ClO2,則ClO2在陽極產生,電極反應式為Cl--5e-+2H2O=ClO2+4H+。
②水電離產生的H+在陰極上放電產生氫氣,轉移電子的物質的量n=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,則在內電路中移動的電荷為0.01 mol,每個Na+帶一個單位的正電荷,則通過陽離子交換膜的陽離子Na+為0.01 mol。


 全優考典單元檢測卷及歸類總復習系列答案
全優考典單元檢測卷及歸類總復習系列答案科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D、E、F的原子序數逐漸增大,A和B同周期,A和F同族,A原子最外層電子數是內層電子數的二倍,B元素族序數是周期數的三倍,B的簡單陰離子與C、D、E的簡單陽離子電子層結構相同。請回答下列有關問題:
(1)F在元素周期表中的位置是_____________。
(2)C2B2的電子式是_________;AB2的結構式是_______。
(3)B、C、D、E離子半徑由大到小的順序為______(用離子符號回答); C、D、E最高價氧化物對應水化物的堿性由強到弱的順序為____________(用化學式表示,且用“>”符號連接回答)。
(4) C、E最高價氧化物對應水化物能夠相互反應,則反應的離子方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種主族元素的單質在常溫下都是常見的無色氣體,在適當條件下,三者之間可以兩兩發生反應生成分別是雙核、三核和四核的甲、乙、丙三種分子,且乙、丙分子中含有X元素的原子個數比為2∶3。請回答下列問題:
(1)元素X的名稱是________,丙分子的電子式為________。
(2)若甲與Y單質在常溫下混合就有明顯現象,則甲的化學式為________。丙在一定條件下轉化為甲和乙的反應方程式為___________________________。
(3)化合物丁含X、Y、Z三種元素,丁是一種常見的強酸,將丁與丙按物質的量之比1∶1混合后所得物質戊的晶體結構中含有的化學鍵為________(選填序號)。
a.只含共價鍵 b.只含離子鍵 c.既含離子鍵,又含共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蘇州工匠用白銅打造的食蟹工具“蟹八件”,主要成分是銅鎳合金。Ni能與CO形成正四面體形的配合物Ni(CO)4,CuSO4溶于氨水形成[Cu(NH3)4]SO4深藍色溶液。
(1)Cu基態原子核外電子排布式為________________。
(2)1 mol Ni(CO)4中含有σ鍵的數目為_______________。
(3)[Cu(NH3)4]SO4中陰離子的空間構型是___________,與SO42-互為等電子體的分子為_______________。(填化學式)
(4) NH3的沸點_______________。(選填“高于”或“低于”)PH3,原因是_______________。
(5)某白銅合金晶胞結構如右圖所示.晶胞中銅原子與鎳原子的個數比為_______________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】填寫下列空白:
(1)某元素的氣態氫化物的化學式XH4,則其最高價氧化物對應的水化物的化學式為_________。
(2)氧元素有三種核素16O、17O、18O,它們在自然界中所占的原子個數百分比分別為a%、b%、c%,則氧元素的相對原子質量為_________________。
(3)物質的量相同的H2O和D2O與足量鈉反應,放出的氣體的質量之比為 ____________。
(4)X2﹣含中子N個,X的質量數為A,則1g X的氫化物中含質子的物質的量是 ______mol。
(5)銣和另一種堿金屬形成的合金4.6g與足量的水反應后,產生0.2 g氫氣,則此合金中另一堿金屬可能是:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學綜合應用
(Ⅰ) 選擇合適的圖象:
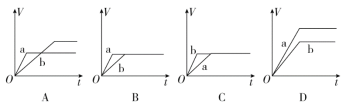
(1)將等質量的兩份鋅粉a、b分別加入過量的稀硫酸中,同時向a中加入少量的CuSO4溶液,產生H2的體積V(L)與時間t(min)的關系是_____________。
(2)將(1)中的CuSO4溶液改成CH3COONa溶液,其他條件不變,則圖象是 。
(Ⅱ)如圖所示,某同學設計了一個燃料電池并探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。請按要求回答相關問題:

(1)甲烷燃料電池負極反應式是_________________________。
(2)乙裝置中鐵極的電極反應式為_______________________。
(3)檢驗石墨(C)極反應產物的方法是____________ _________。
(4)若在標準狀況下,有2.24 L氧氣參加反應,丙裝置中陰極析出銅的質量為________g。

(Ⅲ)Na2FeO4是一種既能殺菌、消毒,又能絮凝凈水的高效水處理劑,其電解制法如圖所示。電解過程中,兩極均有氣體產生,Y極區域溶液逐漸變成紫紅色;停止實驗,鐵電極明顯變細,電解液仍澄清。查閱資料得知,高鐵酸根離子(FeO![]() )在溶液中呈紫紅色。
)在溶液中呈紫紅色。
(1)電解過程中,X極區溶液的pH___________(填“增大”“減小”或“不變”)。
(2)電解過程中,Y極發生的電極反應為Fe-6e-+8OH-===FeO![]() +4H2O和_____ _____。
+4H2O和_____ _____。
(3)若在X極收集到672 mL氣體,在Y極收集到168 mL氣體(均已折算為標準狀況時氣體體積),則Y電極(鐵電極)質量減少__________g。
(4)在堿性鋅電池中,用高鐵酸鉀作為正極材料,電池反應為2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。該電池正極發生的反應的電極反應式為____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]()
![]() 、
、![]() 、
、![]() 、
、![]() 具有相同的電子層結構,有關A、B、C、D四種元素的敘述中正確的是
具有相同的電子層結構,有關A、B、C、D四種元素的敘述中正確的是
A.原子序數:b > a > c >d
B.原子半徑:A > B > C > D
C.金屬性:B > A,非金屬性:D > C
D.離子半徑:D > C > B > A
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com