氫氣是一種新型的綠色能源,又是一種重要的化工原料。
(1)氫氣燃燒熱值高。實驗測得,在常溫常壓下,1g H2完全燃燒生成液態水,放出142.9 kJ熱量。則H2
燃燒的熱化學方程式為__________________________________。
(2)氫氧燃料電池能量轉化率高,具有廣闊的發展前景。現氫氧燃料電池進行下圖所示實驗:
①氫氧燃料電池中,正極的電極反應式為____________
②上圖裝置中,某一銅電極的質量減輕3.2g,則a極上消耗的O
2在標準狀況下的體積為____________L
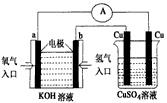
(3)氫氣是合成氨的重要原料,合成氨反應的熱化方程式如下:N
2(g)+3H
2(g)
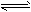
2NH
3(g);
ΔH=-92.4 kJ/mol
①當合成氨反應達到平衡后,改變某一外界條件(不改變N
2、H
2和NH
3的量),反應速率與時間的關系如下圖所示。
圖中t1時引起平衡移動的條件可能是____________其中表示平衡混合物中NH3的含量最高的一段時間是
____________
②溫度為T℃時,將2a mol H2和amol N2放入0.5L密閉容器中,充分反應后測得N2的轉化率為50%。則反應的平衡常數為____________。

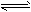 2NH3(g);
2NH3(g);
 氫氣是一種新型的綠色能源,又是一種重要的化工原料.
氫氣是一種新型的綠色能源,又是一種重要的化工原料.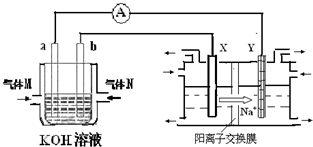 化學在能源開發與利用中起到十分關鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.
化學在能源開發與利用中起到十分關鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.
 化學在能源開發與利用中起著十分關鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.
化學在能源開發與利用中起著十分關鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.