
【題目】正丁醛經催化加氫可制備1-丁醇。為提純含少量正丁醛雜質的1-丁醇,現設計如下路線:
![]()
已知:①正丁醛與飽和NaHSO3溶液反應可生成沉淀;②乙醚的沸點是34℃,難溶于水,與1-丁醇互溶;③1-丁醇的沸點是118℃。則操作1~4分別是( )
A.萃取、過濾、蒸餾、蒸餾 B.過濾、分液、蒸餾、萃取
C.過濾、蒸餾、過濾、蒸餾 D.過濾、分液、過濾、蒸餾
科目:高中化學 來源: 題型:
【題目】NaOH、KOH等堿性溶液可以貯存在下列哪種試劑瓶中()
A. 具有玻璃塞的細口瓶 B. 具有玻璃塞的廣口瓶
C. 帶滴管的滴瓶 D. 具有橡膠塞的細口瓶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理消除工業污染,保護生態環境具有非常重要的意義。
(1)采取熱還原法,用碳粉可將氮氧化物還原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
則反應C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化劑作用下,將nmolSO2與nmolCl2充入容積可變的密閉容器中,發生反應:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始終保持溫度為T,壓強為p。起始時氣體總體積為10L,tmin時反應達到平衡狀態,此時氣體總體積為8L。
SO2Cl2(g)(硫酰氯),并始終保持溫度為T,壓強為p。起始時氣體總體積為10L,tmin時反應達到平衡狀態,此時氣體總體積為8L。
①在容積改變的條件下,反應速率可用單位時間內反應物或生成物的物質的量變化來表示。則v(SO2)= ___ mol/min。
②此溫度下,該反應的K= 。
③相同條件下,若將0.5nmolSO2與0.5nmolCl2充入該容器,到達平衡狀態時,混合物中SO2Cl2的物質的量是 。
(3)利用氨水可以將SO2和NO2吸收,原理如圖所示:
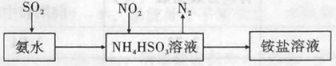
NO2被吸收的離子方程式是 。
(4)利用如下圖所示裝置(電極均為惰性電極)也可吸收SO2,并用陰極排出的溶液吸收NO2。
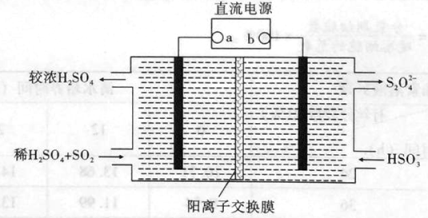
①陰極的電極反應式為 。
②在堿性條件下,用陰極排除的溶液吸收NO2,使其轉化為無害氣體,同時有SO32-生成。該反應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氣體分子中的極性鍵在紅外線的照射下,易像彈簧一樣做伸縮和彎曲運動,從而產生熱量而造成溫室效應.下列不屬于造成溫室效應氣體的是( )
A. CO2 B. N2O C. CH4 D. N2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學——選修3:物質結構與性質】
X、Y、Z、W為前四周期元素且原子序數依次增大,X的電子層數等于核外電子數,Y元素基態原子核外未成對電子數為2且X與Y形成的化合物在常溫下為常見的液體R,Z元素原子最外電子層上s、p電子數相等,W基態原子3d軌道的電子數是4s軌道電子數的3倍。請回答下列問題:
(1)Y基態原子的價電子排布圖為 ,其第一電離能在同周期元素中由大到小排第 位。
(2)W的元素名稱為 ,其基態原子核外有 種空間運動狀態不同的電子。
(3)R的中心原子采取的雜化方式為 ,寫出R的一個等電子體: 。(填化學式)。
(4)Z與Y在一定條件下可形成高硬度的化合物,該化合物的晶體類型為 ,其由Z、Y構成的最小環為 元環。
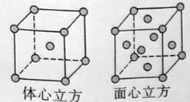
(5)W的單質在900℃以下為α型體心立方晶胞,910℃以上W轉變為γ型面心立方晶胞,晶胞結構分別如圖所示。兩種晶體中距離最近的鐵原子間距離相同。則在800℃和1000℃下,鐵的密度之比為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中草藥秦皮中含有的七葉樹內酯(每個折點表示一個碳原子,氫原子未畫出),具有抗菌作用。若1 mol七葉樹內酯分別與濃溴水和NaOH溶液完全反應,則消耗的Br2和NaOH的物質的量分別為( )
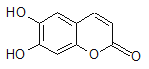
A、2 mol Br2 2 mol NaOH
B、2 mol Br2 3 mol NaOH
C、3 mol Br2 4 mol NaOH
D、4 mol Br2 4 mol NaOH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com