
【題目】下列說法中,正確的是( )
A. 若將15P原子的電子排布式寫成1s22s22p63s23p3p,它違背了泡利原理
B. 金剛石、SiC、NaF、NaCl、H2O、H2S晶體的熔點依次降低
C. 石墨、新型高分子導電材料、聚乙烯、金屬晶體均含有金屬鍵
D. 乳酸[CH3CH(OH)COOH]中存在2個手性碳原子
【答案】B
【解析】A、泡利原理是每個軌道最多容納兩個電子,且自旋的方向相反,洪特規則是同一能級上電子優先單獨占據一個軌道,且自旋反應相同,因此1s22s22p63s23p3p違背了洪特規則,故A錯誤;B、一般不同晶體熔沸點高低順序是原子晶體>離子晶體>分子晶體,金剛石和SiC屬于原子晶體,原子晶體熔沸點高低判斷,一般通過鍵長比較,鍵長越短,熔沸點越高,C的原子半徑小于Si,因此金剛石中C-C鍵長小于SiC中Si-C鍵長,即金剛石的熔點高于SiC,NaF和NaCl屬于離子晶體,離子晶體一般通過晶格能,晶格能越大,熔沸點越高,晶格能與離子所帶電荷數和離子半徑有關,所帶電荷數越多,半徑越小,晶格能越大,熔沸點越高,即F-的半徑小于Cl-,因此NaF熔沸點高于NaCl,H2O和H2S屬于分子晶體,H2O中含有分子間氫鍵,即H2O的熔點高于H2S,因此熔點順序是金剛石>SiC>NaF>NaCl>H2O>H2S,故B正確;C、聚乙烯中不含金屬鍵,故C錯誤;D、手性碳原子是連有4個不同的原子或原子團,乳酸結構式為 ,根據手性碳原子定義,只有1個手性碳原子,故D錯誤。
,根據手性碳原子定義,只有1個手性碳原子,故D錯誤。


科目:高中化學 來源: 題型:
【題目】下列關于金屬說法正確的是
A. 自然界中的金屬元素都以化合態存在
B. 金屬鈉著火,可以用水滅火
C. 鐵在潮濕的空氣中很穩定,但紅熱的鐵絲可與水蒸氣反應
D. Al與NaOH溶液的反應中,每轉移3mole-,就生成1.5molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】復分解反應是中學化學中常見的一種反應類型。復分解反應中,元素的化合價都沒發生變化,都不屬氧化還原反應。
(1)復分解反應存在這樣一個規律:一種較強酸與另一種較弱酸的鹽可以自發地反應,生成較弱酸和較強酸的鹽。已知相同物質的量濃度的溶液,pH大小關系是pH(Na2CO3)>pH(NaClO)>pH(NaHCO3)>pH(NaHS O3)。
①寫出向NaClO溶液中通入少量CO2的化學方程式______________________。
②將混有CO2氣體的SO2氣體,通入NaHSO3飽和溶液,___________(填“能”或“不能”)除去CO2氣體。
(2)復分解反應從形式上看,是一種相互交換成分的反應,在有機反應中,也存在類似形式的反應——“烯烴的復分解”反應。

如果用重氫(D)標記過的烯烴CD3CD![]() CDCD3和烴CH3CH
CDCD3和烴CH3CH![]() CHCH3進行反應,其化學方程式是______________________。
CHCH3進行反應,其化學方程式是______________________。
(3)復分解反應的發生還遵循向生成沉淀、氣體、難電離物質的方向進行。
①甲同學認為CuSO4+H2S![]() H2SO4+CuS↓不能發生,因為該反應違背了“較強酸制較弱酸”的原則。請你判斷甲同學的觀點是否正確,并做出解釋:________________。
H2SO4+CuS↓不能發生,因為該反應違背了“較強酸制較弱酸”的原則。請你判斷甲同學的觀點是否正確,并做出解釋:________________。
②乙同學認為,BaSO3可溶于酸,SO2通入Ba(NO3)2溶液中不發生化學反應,但經過實驗探究發現,有白色沉淀生成,請你寫出相關反應的離子方程式_____________。
(4)電解是一種在通電作用下的氧化還原反應。用電解法可將某工業廢水中的CN-轉變為N2,裝置如上圖所示。電解過程中,陰極區電解質溶液的pH將_____________(填“增大”“減小”或“不變”)。陽極的電極反應式為______________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在濃硝酸中放入銅片:
(1)開始反應的化學方程式為 , 實驗現象為 .
(2)若銅有剩余,則反應將要結束時的反應方程式為 .
(3)待反應停止后,再加入少量25%的稀硫酸,這時銅片上又有氣泡產生,其原因是 .
(4)若將12.8g銅跟一定量的濃硝酸反應,銅消耗完時,共產生5.6L(標準狀況)氣體.則所消耗的HNO3的物質的量為 , 其中顯氧化性的硝酸的物質的量為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘是人類必需的生命元素,在人體的生長發育過程中起著重要作用,實驗小組進行碘單質的制備。
【查閱資料】堿性條件下,I2會發生歧化反應生成I-和IO3-,酸性條件下, I-和IO3-又會發生歸中反應生成I2;碘在水中的溶解度為0.029g。
【碘的制取】以海帶為原料,按照以下步驟進行實驗。

(1)將海帶灼燒成灰后再用水浸取,目的是_______________。
(2)步驟B發生的反應是“氧化”,這一操作中可供選用的試劑: ①Cl2;②Br2;③稀硫酸和H2O2,從無污染角度考慮,你認為合適試劑是______(填編號),反應中I-轉化為I2 的離子反應方程式為_______________。
(3)步驟C中使用的起到分離作用的儀器是_____________,使用該儀器時,第一步操作是_______________。
(4)有同學查資料后發現CCl4有毒,提議用乙醇代替,請判斷該提議是否可行,原因是_______________。
【碘的分離】得到含I2的CCl4溶液后,利用右圖裝置進行碘的提取并回收溶劑。

(5)圖中有兩處明顯錯誤,分別是①_________;②_________。
(6)對實驗裝置的錯誤改正之后進行分離操作。預期錐形瓶中得到無色的CCl4,實驗結果錐形瓶中得到紫紅色液體,請分析出現該實驗結果的原因____________,為了保證實驗成功,請提出改進方案:___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是四種常見的短周期主族元素,其原子半徑隨原子序數的變化如圖所示. 已知Y、Z兩種元素的單質是空氣的主要成分,W原子的最外層電子數與Ne原子的最外層電子數相差l.下列說法正確的是( ) 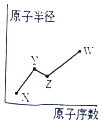
A.Y、Z、W處于同一周期
B.X、Y、Z、W的原子序數遞增
C.X、W可形成化學式為XW的離子化合物
D.簡單離子半徑是Z大于W
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲除去甲烷氣體中混有的乙烯得到純凈的甲烷,最好依次通過盛有( )試劑的裝置.
A.澄清石灰水、濃H2SO4
B.酸性KMnO4溶液、濃H2SO4
C.溴水、濃H2SO4
D.CCl4、堿石灰
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用萃取法從碘水中分離碘,所用萃取劑應具有的性質是( ) ①不和碘或水起化學反應 ②能溶于水 ③不溶于水 ④應是極性溶劑 ⑤應是非極性溶劑.
A.①②⑤
B.②③④
C.①③⑤
D.①③④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com