
【題目】根據下列各反應,判斷有關物質還原性由強到弱的順序是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO+2H2O+Fe(NO3)3
A.![]() B.
B.![]()
C.![]() D.
D.![]()
 教學練新同步練習系列答案
教學練新同步練習系列答案科目:高中化學 來源: 題型:
【題目】已知在25℃時,下列反應的平衡常數如下:
①N2(g)+O2(g)![]() 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列說法正確的是
A.NO分解反應NO(g)![]()
![]() N2(g)+
N2(g)+![]() O2(g)的平衡常數為1×10-30
O2(g)的平衡常數為1×10-30
B.根據K2的值可以判斷常溫下H2和O2很容易反應生成H2O
C.常溫下,NO、H2O、CO2三種物質分解放出O2的傾向順序為NO>H2O>CO2
D.溫度升高,上述三個反應的平衡常數均增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物M(C16H14O2)是一種香料,工業上利用烴A和甲苯為主要原料,按下列路線合成:
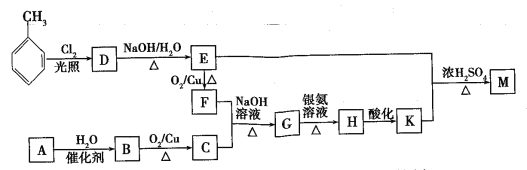
已知:①氣態烴A在標準狀況下的密度是1.25g/L,能作為果實催熟劑;②醛在堿性溶液中能發生羥醛縮合反應,再脫水生成不飽和醛:RCH2CHO+ 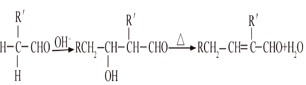 。請回答下列問題:
。請回答下列問題:
(1)K的名稱是___________;G中含有的官能團名稱是______________。
(2)寫出D→E的化學方程式____________________________________。
(3)A→B的反應類型是_______;
(4)同時滿足下列三個條件的K的同分異構體有_____種(不考慮立體異構)。①遇FeCl3溶液發生顯色反應;②能發生銀鏡反應;③除苯環以外不再含有其他環狀結構。其中核磁共振氫譜為五組峰的結構簡式為____。
(5)以乙醇為起始原料,選用必要的無機試劑設計合成1-丁烯的路線。(用結構簡式表示有機物,箭頭上注明試劑和反應條件)____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
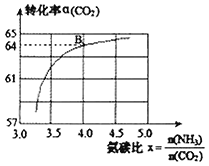
【題目】以![]() 和
和![]() 為原料,通過反應:
為原料,通過反應:![]() 合成尿素。該反應的平衡常數和溫度關系如下表;在一定溫度和壓強下,若原料氣中的
合成尿素。該反應的平衡常數和溫度關系如下表;在一定溫度和壓強下,若原料氣中的![]() 和
和![]() 物質的量之比
物質的量之比![]() 氨碳比
氨碳比![]() 與
與![]() 平衡轉化率
平衡轉化率![]() 的關系如圖,下列說法正確的是
的關系如圖,下列說法正確的是
| 165 | 175 | 185 | 195 |
K |
|
|
|
|
A.如圖點B處![]() 的平衡轉化率為
的平衡轉化率為![]()
B.該反應平衡常數的表達式為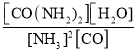
C.該反應中反應物的總鍵能大于生成物的總鍵能
D.氨碳比越高,合成![]() 時
時![]() 的轉化率越高
的轉化率越高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】液體燃料電池相比于氣體燃料電池具有體積小,無需氣體存儲裝置等優點。一種以肼(N2H4)為燃料的電池裝置如圖所示。該電池用空氣中的氧氣作為氧化劑,KOH作為電解質。下列關于該燃料電池的敘述不正確的是( )

A. 電流從右側電極經過負載后流向左側電極
B. 負極發生的電極反應式為N2H4+4OH--4e-===N2↑+4H2O
C. 該燃料電池的電極材料應采用多孔導電材料,以提高電極反應物質在電極表面的吸附量,并使它們與電解質溶液充分接觸
D. 該燃料電池持續放電時,K+從負極向正極遷移,因而離子交換膜需選用陽離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向 2.0 L 濃度均為 1.0 mol·L1 的 CuSO4、Fe2(SO4)3 和 H2SO4 的混合液中加入足量的鐵粉,反應停止后,鐵粉有剩余,此時溶液中 Fe2+ 的物質的量濃度是(溶液的體積變化忽略不計)
A. 1.5 mol·L1 B. 2.0 mol·L1 C. 3.0 mol·L1 D. 5.0 mol·L1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,電離平衡常數:
化學式 | CH3COOH | H2CO3 | HClO | |
電離平衡常數 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列問題:
(1)下列四種離子結合質子的能力由大到小的順序是________________;(填編號)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反應不能發生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸餾水稀釋0.10 mol·L-1的醋酸,則下列各式表示的數值隨水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
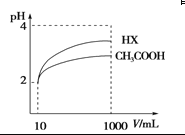
(4)體積為10 mL pH=2的醋酸溶液與一元酸HX分別加水稀釋至1 000 mL,稀釋過程pH變化 如圖,則HX的電離平衡常數________(填“大于”、“等于”或“小于”)醋酸的平衡常數,稀釋后,HX溶液中水電離出來的c(H+)________醋酸溶液中水電離出來的c(H+)(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度分別為T1和T2時,將氣體X和氣體Y各0.16mol充入10L恒容密閉容器中,發生反應X(g)+Y(g)![]() 2Z(g),一段時間后達到平衡,反應過程中測定的數據如下表:
2Z(g),一段時間后達到平衡,反應過程中測定的數據如下表:
溫度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列說法正確的是( )
A. 該反應的正反應為放熱反應
B. T2溫度下此反應的平衡常數K=4
C. 溫度為T1時,0~t1時間段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他條件不變,再充入0.2molZ,平衡時X的體積分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298K時,碳酸、醋酸和亞硫酸的電離平衡常數見下表:
名稱 | 碳酸 | 醋酸 | 亞硫酸 |
電離常數(298K) | K1=4.4×10–7 K2=4.7×10–11 | K=1.8×10–5 | K1=1.3×10–2 K2=6.2×10–8 |
(1)298K時,碳酸、醋酸和亞硫酸,從強到弱的順序_______________________.(用化學式表示)
(2)用離子方程式表示Na2SO3溶液顯堿性的原因_______________________。
(3)25℃時,相同濃度的CH3COONa溶液的堿性________Na2CO3溶液的堿性(填“>”“<”或“=”)。
(4)向醋酸溶液中加少量NaOH溶液,醋酸的電離平衡常數________(填“增大”、“減小”、“不變”).
(5)已知常溫下:某NaHSO3溶液的pH=5,則該NaHSO3溶液中c(H2SO3) ________ c(SO32-)(填“>”“<”或“=”).
(6)25℃時,PH=4的亞硫酸溶液與PH=10的NaOH溶液等體積混合后,溶液顯_________性.
A.酸性 B.堿性 C.中性 D.無法確定
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com