
下列熱化學方程式正確的是(△H的絕對值均正確)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0kJ·mol-1(燃燒熱) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=+57.3kJ·mol-1(中和熱) |
| C.S(s)+O2(g)=SO2(g)ΔH=-269.8kJ·mol-1(反應熱) |
| D.2NO2=2NO+O2ΔH=+116.2kJ·mol-1(反應熱) |
 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:單選題
通常人們把拆開1 mol某化學鍵所消耗的能量看成該化學鍵的鍵能。鍵能的大小可以衡量化學鍵的強弱,也可用于估算化學反應的反應熱(△H),化學反應的△H等于反應物的總鍵能與生成物的總鍵能之差。
| 化學鍵 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 鍵能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
 Si(s)+4HCl(g),該反應的反應熱△H為( )
Si(s)+4HCl(g),該反應的反應熱△H為( )查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列熱化學方程式正確的是(△H的絕對值均正確)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ; ΔH=-1 367.0 kJ·mol-1(燃燒熱) |
| B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l); ΔH=-57.3 kJ·mol-1(中和熱) |
| C.S(s)+O2(g)=SO2(g); ΔH=-269.8 kJ·mol-1(反應熱) |
| D.2NO2=O2+2NO; ΔH=+116.2 kJ·mol-1(反應熱) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知298 K時,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推測含1 mol HCl的稀溶液與含1 mol NH3的稀溶液反應放出的熱量 ( )
| A.大于57.3 kJ | B.等于57.3 kJ |
| C.小于57.3 kJ | D.無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
根據下列熱化學方程式:
(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
(2)H2(g)+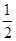 O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ·mol-1
可以計算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反應熱為 ( )
| A.ΔH=+244.1 kJ·mol-1 |
| B.ΔH=-488.3 kJ·mol-1 |
| C.ΔH=-996.6 kJ·mol-1 |
| D.ΔH=+996.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
反應:2H2(g)+O2(g)===2H2O(l)過程中的能量變化如圖所示,下列有關說法中正確的是( )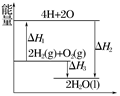
| A.ΔH1<0 | B.ΔH2為該反應的反應熱 |
| C.ΔH3不是H2的燃燒熱 | D.ΔH2=ΔH1+ΔH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
工業生產水煤氣的反應為:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判斷正確的是( )
| A.反應物能量總和小于生成物能量總和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤氣反應中,生成1 mol H2(g)吸收131.4 kJ熱量 |
| D.水煤氣反應中生成1體積CO(g)吸收131.4 kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
碘在不同狀態下(固態或氣態)與氫氣反應的熱化學方程式如下所示:
① H2(g)+I2(?) 2HI(g)+9.48kJ② H2(g)+I2(?)
2HI(g)+9.48kJ② H2(g)+I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判斷正確的是
| A.①中的I2為固態,②中的I2為氣態 |
| B.②的反應物總能量比①的反應物總能量低 |
| C.①的產物比反應②的產物熱穩定性更好 |
| D.1mol 固態碘升華時將吸熱17kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
氫氣雖然是一種理想的綠色能源,但目前仍處在研究、實驗階段,還未得到廣泛應用,其原因可能是
| A.氫氣雖可由水制備獲得,但水資源嚴重匱乏 |
| B.氫氣制備耗能巨大,廉價制氫技術尚未成熟 |
| C.氫氣貯存、運輸等安全技術已經很好地解決了 |
| D.氫氣燃燒產物雖無污染,但其放出熱量較少 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com