
【題目】在容積一定的密閉容器中,置入一定量的NO(g)和足量C(s),發(fā)生反應(yīng)C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡狀態(tài)時NO(g)的物質(zhì)的量濃度[NO]與溫度T的關(guān)系如圖所示。則下列說法中正確的是( )
CO2(g)+N2(g),平衡狀態(tài)時NO(g)的物質(zhì)的量濃度[NO]與溫度T的關(guān)系如圖所示。則下列說法中正確的是( )

A. 該反應(yīng)的ΔH>0
B. 若該反應(yīng)在T1、T2時的平衡常數(shù)分別為K1、K2,則K1<K2
C. 在T2時,若反應(yīng)體系處于狀態(tài)D,則此時一定有v正<v逆
D. 在T3時,若混合氣體的密度不再變化,則可以判斷反應(yīng)達(dá)到平衡狀態(tài)C
【答案】D
【解析】
A.根據(jù)圖像可知,隨著溫度的升高,NO的物質(zhì)的量濃度增大,說明平衡逆向移動,則正反應(yīng)為放熱反應(yīng),故A錯誤;
B.由于正反應(yīng)為放熱反應(yīng),溫度越高,平衡常數(shù)越小,則K1>K2,故B錯誤;
C.根據(jù)圖像可知,由狀態(tài)D到平衡點B,需要減小NO的濃度,所以反應(yīng)正向進(jìn)行,則v正>v逆,故C錯誤;
D.由于反應(yīng)物碳是固體,所以在反應(yīng)進(jìn)行過程中,氣體的總質(zhì)量一直在變,V一定,氣體的密度也就一直在變,當(dāng)若混合氣體的密度不再變化,則可以判斷反應(yīng)達(dá)到平衡狀態(tài)C,故D正確;
答案:D


科目:高中化學(xué) 來源: 題型:
【題目】反應(yīng)4NH3+5O2=4NO+6H2O(g)在5L密閉容器中進(jìn)行,半分鐘后,NO的物質(zhì)的量增加了0.3mo1,則此反應(yīng)的平均速率Vx為( )
A. VO2=0.01mo1L-1s-1B. VNO=0.008mo1L-1s-1
C. VH2O=0.002mo1L-1s-1D. VNH3=0.002mo1L-1s-1
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】榮獲2019年諾貝爾化學(xué)獎的吉野彰是最早開發(fā)具有商業(yè)價值的鋰離子電池的日本科學(xué)家,他設(shè)計的可充電電池的工作原理示意圖如圖所示。該可充電電池的放電反應(yīng)為LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德羅常數(shù)的值。下列說法錯誤的是( )
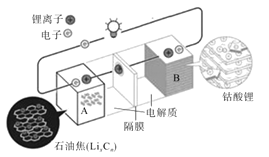
A.該電池用于電動汽車可有效減少光化學(xué)煙霧污染
B.充電時,正極反應(yīng)為LiCoO2-xe-=Li(1-x)CoO2+xLi+
C.放電時,Li+由A極移向B極
D.若初始兩電極質(zhì)量相等,當(dāng)轉(zhuǎn)移2NA個電子時,兩電極質(zhì)量差為14g
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】可逆反應(yīng)3H2+N2![]() 2NH3的正、逆反應(yīng)速率可用各反應(yīng)物或生成物濃度的變化來表示,下列各關(guān)系中能說明反應(yīng)已達(dá)到平衡狀態(tài)的是
2NH3的正、逆反應(yīng)速率可用各反應(yīng)物或生成物濃度的變化來表示,下列各關(guān)系中能說明反應(yīng)已達(dá)到平衡狀態(tài)的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】實驗室用MnO2和濃鹽酸制取氯氣時,有14.6 g氯化氫被氧化,所得Cl2全部用石灰水吸收,可制得漂白粉的質(zhì)量是
A. 14.3 g B. 25.4 g C. 28.6 g D. 50.8 g
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】壽山石![]() 是我國四大印章石之首,被稱為國石。X,Y,M,N是原子序數(shù)依次增大的短周期元素,M元素是地殼中含量最高的金屬元素,N元素的單質(zhì)常用來制造太陽能電池,
是我國四大印章石之首,被稱為國石。X,Y,M,N是原子序數(shù)依次增大的短周期元素,M元素是地殼中含量最高的金屬元素,N元素的單質(zhì)常用來制造太陽能電池,![]() 和
和![]() 含有相同的電子數(shù)。下列說法正確的是
含有相同的電子數(shù)。下列說法正確的是
A.原子半徑:![]()
B.簡單氫化物的穩(wěn)定性:![]()
C.第82號元素與M位于同一主族
D.X和M形成的化合物溶于水顯酸性
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】兩種金屬混合粉末15g,與足量的鹽酸反應(yīng)時生成11.2L H2(標(biāo)況下),符合上述情況的金屬混合物是( )
A. Mg、Fe B. Zn、Ag C. Fe、Zn D. Mg、Al
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】鐵是生產(chǎn)生活中應(yīng)用最廣泛的金屬,煉鐵技術(shù)備受關(guān)注,已知:
①![]()
![]()
②![]()
![]()
③斷裂![]() 氣體中的化學(xué)鍵需要吸收1076kJ的能量,斷裂
氣體中的化學(xué)鍵需要吸收1076kJ的能量,斷裂![]() 氣體中的化學(xué)鍵需要吸收1490kJ的能量。
氣體中的化學(xué)鍵需要吸收1490kJ的能量。
請回答:
(1)斷裂![]() 中所有化學(xué)鍵需要吸收的能量為________kJ。
中所有化學(xué)鍵需要吸收的能量為________kJ。
(2)T1℃時,向密閉容器中加入一定量的![]() 和C,發(fā)生反應(yīng)①,達(dá)到平衡后
和C,發(fā)生反應(yīng)①,達(dá)到平衡后![]() 的濃度為
的濃度為![]() ;其他條件不變,縮小容器體積,再次達(dá)到平衡時,
;其他條件不變,縮小容器體積,再次達(dá)到平衡時,![]() 的濃度為
的濃度為![]() ,則a________b(選填“>”“<”或“=”)。
,則a________b(選填“>”“<”或“=”)。
(3)起始溫度均為T2℃時,向容積為10L的三個恒容密閉容器中,分別加入一定量的![]() 和CO發(fā)生反應(yīng)②,測得相關(guān)數(shù)據(jù)如表所示:
和CO發(fā)生反應(yīng)②,測得相關(guān)數(shù)據(jù)如表所示:
編號 | 容器 | 起始時物質(zhì)的量/mol | 平衡時物質(zhì)的量/mol | 平衡常數(shù)(K) | |
|
|
| |||
1 | 恒溫 | 0.5 | 1.5 | 0.8 K1 | |
2 | 恒溫 | 2 | 3 | M | K2 |
3 | 絕熱 | 1 | 1.5 | n | K3 |
①T2℃時,容器1中反應(yīng)的平衡常數(shù)K1=_______。
②容器2中,5min達(dá)到平衡,則0~5min以![]() 表示該反應(yīng)的速率
表示該反應(yīng)的速率![]() ___________。
___________。
③對于三個容器中的反應(yīng),下列說法正確的是(填字母)_________。
A.![]() B.容器1和容器2中
B.容器1和容器2中![]() 的平衡轉(zhuǎn)化率
的平衡轉(zhuǎn)化率![]()
C.![]() D.平衡時氣體壓強(qiáng):
D.平衡時氣體壓強(qiáng):![]()
(4)一定條件下,向恒壓密閉容器中充入0.5mol ![]() 和1.0mol CO,發(fā)生反應(yīng)②,CO和
和1.0mol CO,發(fā)生反應(yīng)②,CO和![]() 的物質(zhì)的量濃度(c)與時間(t)的關(guān)系如圖所示:
的物質(zhì)的量濃度(c)與時間(t)的關(guān)系如圖所示:

①6min時改變的外界條件為________________。
②若在6min時,恒溫將容器體積擴(kuò)大到10L,請在圖中畫出6~10min![]() 的物質(zhì)的量濃度隨時間變化的曲線_________。
的物質(zhì)的量濃度隨時間變化的曲線_________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】下列敘述正確的是( )
A.膠體的本質(zhì)特征是丁達(dá)爾效應(yīng)
B.焰色反應(yīng)是元素的性質(zhì),屬于化學(xué)變化
C.密度為1.84g/ml、98%的硫酸,其物質(zhì)的量濃度為1.84mol/L
D.NA個HCl分子的質(zhì)量(以克為單位)與其相對分子質(zhì)量在數(shù)值上相等
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com