
【題目】鉑鈷合金是以鉑為基含鈷二元合金,在高溫下,鉑與鉆可無限互溶,其固體為面心立方晶格。鉑鉆合金磁性極強,磁穩定性較高,耐化學腐蝕性很好,主要用于航天航空儀表、電子鐘表、磁控管等。氟及其化合物CuF用途非常廣泛。回答下列問題:
(1)聚四氟乙烯是一種準晶體,準晶體是一種無平移周期序,但有嚴格準周期位置序的獨特晶體,可通過________________方法區分晶體、準晶體和非晶體。
(2)基態F原子的價層電子排布圖(軌道表達式)為________________。
(3) [H2F]+[SbF6]ˉ (氟銻酸)是一種超強酸,存在[H2F]+,該離子的空間構型為______________,與[H2F]+具有相同空間構型且中心原子與F原子同周期的分子是_____________。
(4)NH4F(氟化銨)可用于玻璃的蝕刻防腐劑、消毒劑。![]() 中心原子的雜化類型是____________;氟化銨中存在_______________(填字母)。
中心原子的雜化類型是____________;氟化銨中存在_______________(填字母)。
A.離子鍵 B.σ鍵 C.π鍵 D.氫鍵
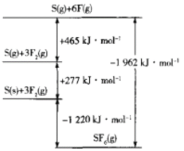
(5)SF4被廣泛用作高壓電氣設備的絕緣介質。SF4是一種共價化合物,可通過類似于Bom-Haber循環能量構建能量圖計算相關鍵能。則F-F鍵的鍵能為_____kJ/mol,S-F鍵的鍵能為______ kJ/mol。
(6)CuCl的熔點為326℃,能升華,熔化呈液態時不導電;CuF的熔點為1008℃,熔化呈液態時能導電。
①CuF中Cu+的基態價電子排布式________銅元素位于元素周期________區,金屬Cu的堆積模型為__________________。
②CuF的熔點比CuCl的高,原因是______________
③已知NA為阿伏加德羅常數的值,CuF的密度為7.1g/cm3,晶胞結構如圖所示,則CuF的晶胞參數a=_______nm(列出計算式)
【答案】X-射線衍射實驗 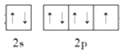 V形 H2O sp3 AB 155 327 3d10 ds 面心立方最密堆積 CuF為離子晶體,CuCl為分子晶體
V形 H2O sp3 AB 155 327 3d10 ds 面心立方最密堆積 CuF為離子晶體,CuCl為分子晶體 ![]() ×107
×107
【解析】
(2)根據核外電子排布規律寫出F的核外電子排布,再畫出價電子排布圖;
(3)根據同族替換和等量代換原則找等電子體,等電子體具有相同的空間構型;
(4)根據價層電子對互斥理論判斷原子的雜化方式;
(5)在標準狀況下,將1mol氣態分子解離為氣態原子所需的能量;
(6)離子晶體熔沸點高于分子晶體;根據均攤法計算晶胞中各微粒的數目,確定晶胞的質量,根據![]() 計算晶胞參數。
計算晶胞參數。
(1)從外觀無法區分晶體、準晶體和非晶體,但用X光照射會發現:晶體對X射線發生衍射,非晶體不發生衍射,準晶體介于二者之間,因此通過X-射線衍射實驗可區分晶體、準晶體和非晶體;
(2)F的原子序數為9,核外電子排布式為1s22s22p5,價電子為2s22p5,因此基態F原子的價電子排布圖為 ;
;
(3)[H2F]+的中心原子的價層電子對數為![]() =4,含有兩對孤對電子,所以空間構型為V形;原子總數相同,價電子總數相同的分子或離子互為等電子體,結構相似,所以與[H2F]+具有相同空間構型且中心原子與F原子同周期的分子是H2O;
=4,含有兩對孤對電子,所以空間構型為V形;原子總數相同,價電子總數相同的分子或離子互為等電子體,結構相似,所以與[H2F]+具有相同空間構型且中心原子與F原子同周期的分子是H2O;
(4)![]() 中心原子的價層電子對數為4,所以為sp3雜化;NH4F中氟離子和銨根之間為離子鍵,銨根內部共價鍵和配位鍵均為σ鍵,所以選AB;
中心原子的價層電子對數為4,所以為sp3雜化;NH4F中氟離子和銨根之間為離子鍵,銨根內部共價鍵和配位鍵均為σ鍵,所以選AB;
(5)由圖象可知,3molF2(g)形成F(g)斷裂3molF-F鍵,吸收465kJ能量,則F-F鍵的鍵能為155kJmol-1;由圖可知1molS(g)和6molF(g)形成SF6(g)要形成6molS-F鍵,放出1962kJ能量,則S-F的鍵能為![]() kJmol-1=327kJmol-1;
kJmol-1=327kJmol-1;
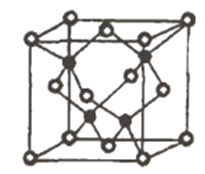
(6)①Cu元素為29號元素,基態Cu原子的核外電子排布式為1s22s22p63s23p63d104s1,失去最外層一個電子形成Cu+,所以Cu+的價電子排布式為3d10;銅元素位于第四周期第IB族,所以屬于ds區;金屬銅為面心立方最密堆積;
②CuCl的熔點為426℃,熔化時幾乎不導電,應為分子晶體,而CuF為離子晶體,一般離子晶體的熔沸點比分子晶體高,所以CuF比CuCl熔點高;
③根據均攤法,晶胞內部黑球個數為4,晶體化學式為CuF,所以白球個數也為4,即晶胞中有4個亞銅離子和4個氟離子,所以晶胞的質量為m=![]() g,晶胞體積V=a3,晶體的密度
g,晶胞體積V=a3,晶體的密度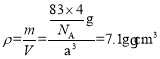 ,可解得a=
,可解得a=![]() ×107nm。
×107nm。


 培優口算題卡系列答案
培優口算題卡系列答案 開心口算題卡系列答案
開心口算題卡系列答案科目:高中化學 來源: 題型:
【題目】某小組探究Na2S溶液與KMnO4溶液反應,實驗過程如下:
實驗序號 | Ⅰ | Ⅱ |
實驗過程 | 滴加6滴(約0.3mL)0.01mol/LNa2S溶液
| 滴加6滴(約0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
實驗現象 | 紫色變淺(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黃色(pH≈8),生成淺粉色沉淀(MnS) |
資料:ⅰ.![]() 在強酸性條件下被還原為Mn2+,在近中性條件下被還原為MnO2。
在強酸性條件下被還原為Mn2+,在近中性條件下被還原為MnO2。
ⅱ.單質硫可溶于硫化鈉溶液,溶液呈淡黃色。
下列說法不正確的是( )。
A.根據實驗可知,Na2S被氧化
B.取少量實驗Ⅰ所得溶液進行實驗,檢測到有![]() ,不能說明S2-被
,不能說明S2-被![]() 氧化為
氧化為![]()
C.實驗Ⅰ中生成棕褐色沉淀,說明酸性條件下S2-能將![]() 還原為MnO2
還原為MnO2
D.實驗Ⅱ得到淺粉色沉淀,是由于S2-將新生成的![]() 還原為Mn2+并迅速與其結合所致
還原為Mn2+并迅速與其結合所致
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應既屬于離子反應,又屬于氧化還原反應的是( )
A. NaOH溶液與鹽酸中和B. Zn與CuSO4 溶液的反應
C. 分解氯酸鉀制氧氣D. MgCl2溶液 與KOH溶液產生沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種長效、緩釋阿司匹林的合成路線如下圖所示:
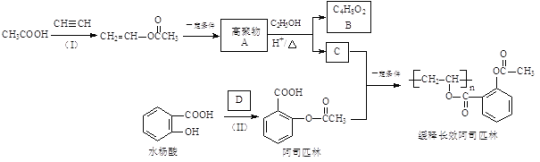
完成下列填空:
已知: RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烴基)
RCOOR"+R′OH(R、R′、R"代表烴基)
(1)結構簡式:A______________,B_______________;
(2)反應(Ⅰ)的反應類型為_________________,緩釋長效阿司匹林結構中與“緩釋作用”有關的官能團的名稱為________________。
(3)D為乙酸酐,結構簡式為![]() ,寫出一種與D互為同分異構體且能發生銀鏡反應的酯類的結構簡式:__________。
,寫出一種與D互為同分異構體且能發生銀鏡反應的酯類的結構簡式:__________。
(4)已知水楊酸酸性主要來源于“![]() ”,阿司匹林中將“
”,阿司匹林中將“![]() ”轉化為“
”轉化為“![]() ”能大大降低對腸胃的刺激,由此你可以得出的結論是_________。
”能大大降低對腸胃的刺激,由此你可以得出的結論是_________。
(5)已知:①乙炔與無機酸的反應和反應(Ⅰ)類似;②![]() ,現以乙炔、甲醇為原料,無機試劑任選,合成丙烯酸甲酯(
,現以乙炔、甲醇為原料,無機試劑任選,合成丙烯酸甲酯(![]() )_________。(合成路線常用的表示方式為:
)_________。(合成路線常用的表示方式為:![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用以下裝置制備并檢驗Cl2的性質。下列說法正確的是( )
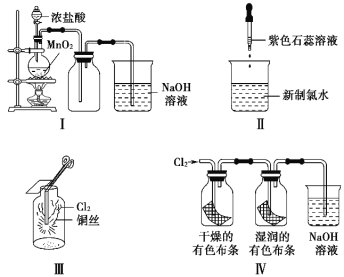
A. Ⅰ圖:若MnO2過量,則濃鹽酸可全部消耗完
B. Ⅱ圖:證明新制氯水只有酸性
C. Ⅲ圖:產生了棕黃色的霧
D. Ⅳ圖:濕潤的有色布條褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學興趣小組對某品牌牙膏中的摩擦劑成分及其含量進行以下探究。查得資料:該牙膏摩擦劑由碳酸鈣、氫氧化鋁組成;牙膏中其它成分遇到鹽酸時無氣體產生。
I.摩擦劑中氫氧化鋁的定性檢驗,取適量牙膏樣品,加水充足攪拌、過濾。
(1)往濾渣中加入過量![]() 溶液,過濾。氫氧化鋁與
溶液,過濾。氫氧化鋁與![]() 溶液反應的離子方程式是___________
溶液反應的離子方程式是___________
(2)往(1)所得濾液中先通入過量二氧化碳,再加入過量稀鹽酸,觀察的現象是__________
Ⅱ.牙膏樣品中碳酸鈣的定量測定。利用如圖所示裝置(圖中夾持儀器略去)進行實驗,充分反應后,測定C中生成的![]() 沉淀質量,以確定碳酸鈣的質量分數。
沉淀質量,以確定碳酸鈣的質量分數。
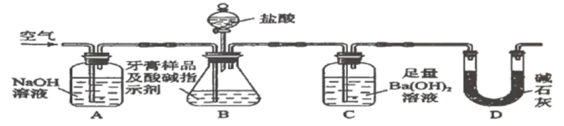
依據實驗過程回答下列問題:
(3)實驗過程中需持續緩緩通入空氣。其作用除了可攪拌B、C中的反應物外,還有:_____。
(4)C中反應生成沉淀的離子方程式是_______________。
(5)下列各項措施中,不能提高測定準確度的是________(填標號)。
a.在加入鹽酸之前,應排凈裝置內的![]() 氣體
氣體
b.滴加鹽酸不宜過快
c.在A-B之間增添盛有濃硫酸的洗氣裝置
d.在B-C之間增添盛有飽和碳酸氫鈉溶液的洗氣裝置
(6)實驗中準確稱取![]() 樣品三份,進行三次測定,測得
樣品三份,進行三次測定,測得![]() 平均質量為
平均質量為![]() 。則樣品中碳酸鈣的質量分數為_____________________。
。則樣品中碳酸鈣的質量分數為_____________________。
(7)有人認為不必測定C中生成的![]() 質量,只要測定裝置C在吸收
質量,只要測定裝置C在吸收![]() 前后的質量差,一樣可以確定碳酸鈣的質量分數。實驗證明按此方法測定的結果明顯偏高,原因是____________________。
前后的質量差,一樣可以確定碳酸鈣的質量分數。實驗證明按此方法測定的結果明顯偏高,原因是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮可形成多種氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的結構式分別是![]() 和
和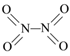 。實驗測得N-N鍵鍵能167kJ·mol-1,NO2中氮氧鍵的平均鍵能466 kJ·mol-1,N2O4中氮氧鍵的平均鍵能為438.5 kJ·mol-1。
。實驗測得N-N鍵鍵能167kJ·mol-1,NO2中氮氧鍵的平均鍵能466 kJ·mol-1,N2O4中氮氧鍵的平均鍵能為438.5 kJ·mol-1。
(1)寫出N2O4轉化為NO2的熱化學方程式_________________________
(2)對反應N2O4(g)![]() 2NO2(g),在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是______
2NO2(g),在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是______
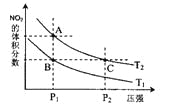
A.A、C兩點的反應速率:A>C
B.B、C兩點的氣體的平均相對分子質量:B<C
C.A、C兩點氣體的顏色:A深,C淺
D.由狀態B到狀態A,可以用加熱的方法
(3)在100℃時,將0.400mol的NO2氣體充入2 L抽空的密閉容器中,每隔一定時間就對該容器內的物質進行分析,得到如下表數據:
時間(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述條件下,從反應開始直至20 s時,二氧化氮的平均反應速率為_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),該反應的平衡常數K的值為_____________,升高溫度后,反應2NO2![]() N2O4的平衡常數K將_______(填“增大”、“減小”或“不變”)。
N2O4的平衡常數K將_______(填“增大”、“減小”或“不變”)。
③若在相同情況下最初向該容器充入的是N2
④計算③中條件下達到平衡后混合氣體的平均相對分子質量為____________。(結果保留小數點后一位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國成功研制出丁苯酞,標志著我國在腦血管疾病治療藥物研究領域達到了國際先進水平。合成丁苯酞(J)的一種路線如下:
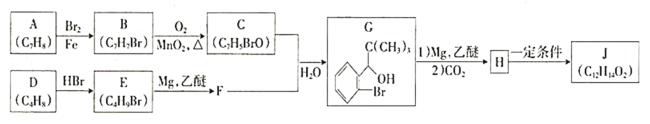
已知:
①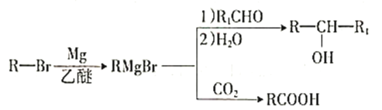
②E的核磁共振氫譜只有一組峰;
③J是一種酯,分子中除苯環外還含有一個五元環。
回答下列問題:
(1)A的化學名稱為________,H中官能團的名稱為________、________。
(2)由A生成B反應類型為__________________。
(3)由D生成E的化學方程式為__________________。
(4)J的結構簡式為________________。
(5)![]() 與CO2反應生成X,X的同分異構體中:
與CO2反應生成X,X的同分異構體中:
①能發生水解反應;②能發生銀鏡反應;能與氯化鐵溶液發生顯色反應。
滿足上述條件X的同分異構體共有________種(不考慮立體異構),寫出核磁共振氫譜有五組峰的同分異構體結構簡式___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是中學化學實驗中常見的制備氣體并進行某些物質的檢驗和性質實驗的裝置,A是制備氣體的裝置,C、D、E、F中盛裝的液體可能相同,也可能不同。試回答:

(1)如果A中的固體物質是碳,分液漏斗中盛裝的是濃硫酸,試寫出發生的化學反應方程式:____,若要檢驗生成的產物,則B、C、D、E、F中應分別加入的試劑為__、__、__、__、__,E中試劑和C中相同,E中試劑所起的作用__,B裝置除可檢出某產物外,還可起到__作用。
(2)若進行上述實驗時在F中得到10.0 g固體,則A中發生反應轉移的電子數為__個。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com