
【題目】對于化學反應的限度的敘述,錯誤的是
A.化學反應的限度與時間的長短無關
B.化學反應達到限度時,正、逆反應速率相等
C.化學反應的限度是不可改變的
D.任何可逆反應都有一定的限度
 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案科目:高中化學 來源: 題型:
【題目】可以證明可逆反應N2(g)+3H2(g)![]() 2NH3(g)已達到平衡狀態的是
2NH3(g)已達到平衡狀態的是
①1個N![]() N鍵斷裂的同時,有3個H-H鍵斷裂 ②1個N
N鍵斷裂的同時,有3個H-H鍵斷裂 ②1個N![]() N鍵斷裂的同時,有6個N-H鍵斷裂 ③其他條件不變時,混合氣體平均相對分子質量不再改變 ④恒溫恒容時,體系壓強不再改變 ⑤NH3、N2、H2的體積分數都不再改變 ⑥恒溫恒容時,混合氣體的密度保持不變 ⑦正反應速率v(H2)=0.6mol/(L·min),逆反應速率v(NH3)=0.4mol/(L·min)
N鍵斷裂的同時,有6個N-H鍵斷裂 ③其他條件不變時,混合氣體平均相對分子質量不再改變 ④恒溫恒容時,體系壓強不再改變 ⑤NH3、N2、H2的體積分數都不再改變 ⑥恒溫恒容時,混合氣體的密度保持不變 ⑦正反應速率v(H2)=0.6mol/(L·min),逆反應速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示的實驗設計能達到相應實驗目的的是
A. 檢驗溴乙烷消去的產物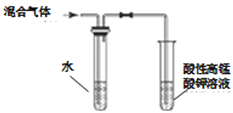
B. 檢驗FeCl3溶液中是否混有Fe2+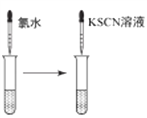
C. 檢驗亞硫酸鈉溶液是否變質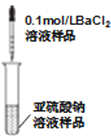
D. 驗證鋼鐵的析氫腐蝕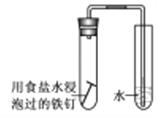
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,HA為一元弱酸。已知溶液中HA、A-的物質的量分數δ隨溶液pH變化的曲線如右圖所示。向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列不正確的是
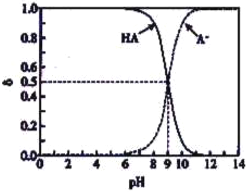
A. 常溫下,HA的電離平衡常數Ka=10-9 B. x=0時,1<pH<7
C. x=5時,C(A-)=c(HA) D. x=10時,c(A-)+c(HA)=c(Na+)=0.05mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,某氣態平衡體系的平衡常數表達式為K=![]() ,有關該平衡體系的說法正確的是( )
,有關該平衡體系的說法正確的是( )
A. 升高溫度,平衡常數K一定增大
B. 增大A濃度,平衡向正反應方向移動
C. 增大壓強,C體積分數增加
D. 升高溫度,若B的百分含量減少,則正反應是放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室利用石灰石與稀鹽酸反應制取二氧化碳,為了降低其反應速率,下列措施可行的是( )
A. 使用濃鹽酸 B. 向反應體系中加入氯化鈣晶體
C. 提高反應溫度 D. 向反應體系中加入蒸餾水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學按下圖進行實驗,在A中放的是干燥的紅色紙條,B中放的是濕潤的紅色紙條,C中盛放的是氫氧化鈉溶液。請回答下列問題:
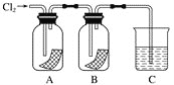
(1)通氯氣一段時間后,A中觀察到的現象是______________________________,B中觀察到的現象是_________________,由此可得出的結論是____________________________,寫出有關反應的化學方程式:____________________。
(2)C裝置的作用是____________________,理由是_______________________________,寫出有關反應的化學方程式:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】五水硫酸銅(CuSO4·5H2O)和六水硫酸亞鐵銨[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分廣泛。
請回答與這兩種物質中元素有關的一些問題。
(1)基態鐵原子的核外電子排布式為_______;基態銅原子的電子占據的最高能層符號為_______ 。
(2)氧元素的第一電離能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三種微粒中,空間構型為正四面體的是_______;NH4+中氮原子的雜化軌道類型是_______。
(4)寫出與SO42-互為等電子體的分子的化學式_______ (寫一種)。
(5)Cu與Au的合金可形成面心立方最密堆積的晶體,在該晶胞中Cu原子處于面心,該晶體具有儲氫功能,氫原子可進入到Cu原子與Au原子構成的立方體空隙中,儲氫后的晶胞結構與金剛石晶胞結構(如圖)相似,該晶體儲氫后的化學式為_______,若該晶體的密度為ρg.cm-3,則晶胞中Cu原子與Au原子中心的最短距離d=_______cm(NA表示阿伏加德羅常數的值)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿伏伽德羅常數的數值為,下列敘述正確的是( )
A.標準狀況下,22.4L四氯化碳含有的分子數為NA
B.1 mol硫酸鉀中陰離子所帶的電荷數為2NA
C.0.5 molL﹣1NaOH溶液中 Na+數為0.5NA
D.常溫常壓下,16g氧氣所含電子數為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com