
【題目】實驗室用H2還原WO3制備金屬W的裝置如圖所示(Zn粒中往往含有碳等雜質,焦性沒食子酸溶液用于吸收少量氧氣),下列說法正確的是( )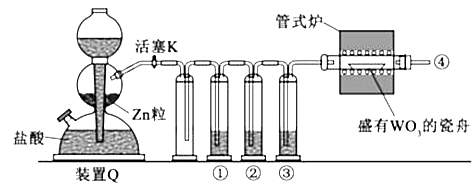
A.①、②、③中依次盛裝KMNO4溶液、濃H2SO4、焦性沒食子酸溶液
B.管式爐加熱前,用試管在④處收集氣體并點燃,通過聲音判斷氣體濃度
C.結束反應時,先關閉活塞K,再停止加熱
D.裝置Q(啟普發生器)也可用于二氧化錳與濃鹽酸反應制備氯氣
【答案】B
【解析】A.氣體從焦性沒食子酸溶液中逸出,得到的氫氣混有水蒸氣,應最后通過濃硫酸干燥,故A錯誤;
B.點燃酒精燈進行加熱前,應檢驗氫氣的純度,以避免不純的氫氣發生爆炸,可點燃氣體,通過聲音判斷氣體濃度,聲音越尖銳,氫氣的純度越低,故B正確;
C.實驗結束后應先停止加熱再停止通入氫氣,使W處在氫氣的氛圍中冷卻,以避免W被重新氧化,故C錯誤;
D.二氧化錳與濃鹽酸需在加熱條件下反應,而啟普發生器不能加熱,故D錯誤.
故選B.
H2還原WO3制備金屬W,裝置Q用于制備氫氣,因鹽酸易揮發,則①、②、③應分別用于除去HCl、氧氣和水,得到干燥的氫氣與WO3在加熱條件下制備W,實驗結束后應先停止加熱再停止通入氫氣,以避免W被重新氧化,以此解答該題.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:
【題目】下列4個化學反應,與其他3個反應類型不同的是( )
A.CH2═CH﹣CH3+HCl ![]() CH3CHCH3Cl
CH3CHCH3Cl
B.CH3CHO+H2 ![]() CH3CH2OH
CH3CH2OH
C.CH3CH2Br+NaOH ![]() CH2═CH2↑+NaBr+H2O
CH2═CH2↑+NaBr+H2O
D.CH≡CH+Br2→ 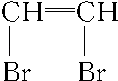
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.反應N2 (g)+3H2 (g)2NH3 (g)的△H<0,△S>0
B.地下鋼鐵管道用導線連接鋅塊可以減緩管道的腐蝕
C.常溫下,Ksp[Mg(OH)2]=5.6×10﹣12 , pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10﹣4 molL﹣1
D.常溫常壓下,鋅與稀H2SO4反應生成11.2 L H2 , 反應中轉移的電子數為6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】B . [實驗化學]
1﹣溴丙烷是一種重要的有機合成中間體,沸點為71℃,密度為1.36gcm﹣3 . 實驗室制備少量1﹣溴丙烷的主要步驟如下:
步驟1:在儀器A中加入攪拌磁子、12g正丙醇及20mL水,冰水冷卻下緩慢加入28mL濃H2SO4;冷卻至室溫,攪拌下加入24g NaBr.
步驟2:如圖所示搭建實驗裝置,緩慢加熱,直到無油狀物餾出為止.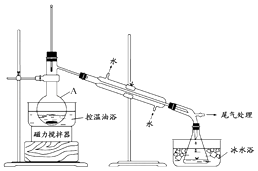
步驟3:將餾出液轉入分液漏斗,分出有機相.
步驟4:將分出的有機相轉入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗滌,分液,得粗產品,進一步提純得1﹣溴丙烷.
(1)儀器A的名稱是;加入攪拌磁子的目的是攪拌和 .
(2)反應時生成的主要有機副產物有2﹣溴丙烷和 .
(3)步驟2中需向接受瓶內加入少量冰水并置于冰水浴中的目的是 .
(4)步驟2中需緩慢加熱使反應和蒸餾平穩進行,目的是 .
(5)步驟4中用5%Na2CO3溶液洗滌有機相的操作:向分液漏斗中小心加入12mL 5% Na2CO3溶液,振蕩, , 靜置,分液.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下將NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示.下列敘述錯誤的是( )
A.Ka2(H2X)的數量級為10﹣6
B.曲線N表示pH與lg ![]() 的變化關系
的變化關系
C.NaHX溶液中c(H+)>c(OH﹣)
D.當混合溶液呈中性時,c(Na+)>c(HX﹣)>c(X2﹣)>c(OH﹣)=c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)Li4Ti3O12和LiFePO4都是鋰離子電池的電極材料,可利用鈦鐵礦(主要成分為Fe TiO3 , 還含有少量MgO、SiO2等雜質)來制備,工藝流程如下:
回答下列問題:
(1)“酸浸”實驗中,鐵的浸出率結果如下圖所示.由圖可知,當鐵的凈出率為70%時,所采用的實驗條件為 . 
(2)“酸浸”后,鈦主要以TiOCl42﹣形式存在,寫出相應反應的離子方程式 .
(3)TiO2xH2O沉淀與雙氧水、氨水反應40min所得實驗結果如下表所示:
溫度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2xH2O轉化率/% | 92 | 95 | 97 | 93 | 88 |
分析40℃時TiO2xH2O轉化率最高的原因 .
(4)Li2Ti5O15中Ti的化合價為+4,其中過氧鍵的數目為 .
(5)若“濾液②”中c(Mg2+)=0.02molL﹣1 , 加入雙氧水和磷酸(設溶液體積增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此時是否有Mg3(PO4)2沉淀生成?(列式計算).FePO4、Mg3(PO4)2的分別為1.3×10﹣22、1.0×10﹣24
(6)寫出“高溫煅燒②”中由FePO4制備LiFePO4的化學方程式 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應前后肯定沒有變化的是
①原子數 ②分子數 ③元素種類 ④物質的總質量 ⑤物質的種類 ⑥共價鍵數
A. ②④⑥B. ①③④C. ①③⑤D. ①③⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在實驗室中用二氧化錳跟濃鹽酸反應制備干燥純凈的氯氣.進行此實驗,所用儀器如圖1: 
(1)連接上述儀器的正確順序(填各接口處的字母):接E接;接;接;接 .
(2)裝置中,濃硫酸的作用是;NaOH溶液的作用是 .
(3)化學實驗中常用濕潤的淀粉﹣KI試紙檢驗是否有Cl2產生.如果有Cl2產生,可觀察到
(4)寫出下列化學反應的方程式: ①氣體發生裝置中進行的反應:
②NaOH溶液中發生反應的離子方程式:
Ⅱ.向共含有0.05mol Al3+、Fe3+的溶液中滴入1mol/L NaOH溶液,生成沉淀的量與加入NaOH溶液的體積關系如圖2所示.則溶液中Al3+物質的量為 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com