
【題目】實驗過程中,下列溶液的導電能力變化不大的是
A. ![]() 溶液中滴入
溶液中滴入![]() 溶液至過量
溶液至過量
B. 醋酸溶液中滴入氨水至過量
C. 澄清石灰水中通入![]() 至過量
至過量
D. ![]() 溶液中加入適量的NaOH固體
溶液中加入適量的NaOH固體
【答案】D
【解析】導電能力的大小,要比較單位體積內離子濃度的大小。A、氫氧化鋇是強電解質,加入硫酸后,反應生成硫酸鋇沉淀和水,導電能力下降直至為零,然后隨著H2SO4溶液的滴入,導電性增強,A錯誤;B、醋酸是弱酸,導電能力不大,加入氨水后,生成醋酸銨是強電解質,導電能力增強,導電性變化大,B錯誤;C、氫氧化鈣是強電解質,通入二氧化碳后會產生白色沉淀碳酸鈣和水,導電能力幾乎變為零,再通入二氧化碳,會生成碳酸氫鈣,導電性又會逐漸增強,溶液的導電能力變化較大,C錯誤;D、氯化銨為強電解質,加入NaOH后生成弱電解質一水合氨和強電解質NaCl,離子的濃度變化不大,故導電性變化不大,D正確;答案選D。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
【題目】已知MnO2為黑色難溶于水的固體,實驗室制取氧氣的反應為2KClO3![]() 2KCl+3O2↑,反應后從剩余固體中回收二氧化錳的操作順序正確的是( )
2KCl+3O2↑,反應后從剩余固體中回收二氧化錳的操作順序正確的是( )
A. 溶解、過濾、蒸發、洗滌 B. 溶解、過濾、洗滌、加熱
C. 溶解、蒸發、洗滌、過濾 D. 溶解、洗滌、過濾、加熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用AgNO3溶液分別滴定濃度均為0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡圖像如下圖所示(不考慮C2O42-的水解)。下列敘述正確的是
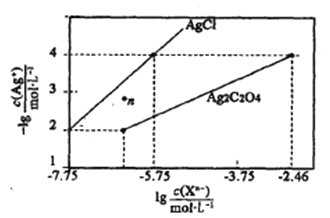
A. Ksp(Ag2C2O4)的數量級等于10-7
B. n點表示AgCl的不飽和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液時,先生成Ag2C2O4沉淀
D. Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常數為109.04
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種驅動潛艇的液氨-液氧燃料電池原理示意如圖,下列有關該電池說法正確的是( )
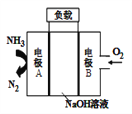
A. 電流由電極A經外電路流向電極B
B. 電池工作時,OH-向電極B移動
C. 該電池工作時,每消耗22.4L NH3轉移3mol電子
D. 電極A上發生的電極反應為:2NH3-6e-+ 6OH-=N2 + 6H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某白色粉末由兩種物質組成,為鑒別其成分進行如下實驗:
①取少量樣品加入足量水仍有部分固體未溶解;再加入足量稀鹽酸,有氣泡產生,固體全部溶解;
②取少量樣品加入足量稀硫酸有氣泡產生,振蕩后仍有固體存在。
該白色粉末可能為( )
A. ![]() 、
、![]() B. AgCl、
B. AgCl、![]()
C. ![]() 、
、![]() D.
D. ![]() 、
、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列物質:①氫氧化鋇固體 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳氣體 ⑥銅 ⑦碳酸鈉粉末 ⑧蔗糖晶體 ⑨熔融氯化鈉 ⑩CuSO4·5H2O晶體。請用序號填空:
(1)上述狀態下可導電的是____________________________________。
(2)屬于電解質的是__________________________________________。
(3)屬于非電解質的是____________________________________。
(4)②在水溶液中的電離方程式為_____________________,①與②在溶液中反應使溶液呈中性的離子方程式為______________________________________________。
(5)③與⑥可以發生如下反應:Cu+4HNO3(濃) =Cu(NO3)2+2NO2↑+2H2O,回答下列問題:
I.還原產物是________。
II.當有2 mol HNO3參加反應時,被氧化的物質的質量為________g。
Ⅲ.用單線橋法標出反應中電子轉移的方向和數目________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為1.00 L的容器中,通入一定量的N2O4,發生反應N2O4(g) ![]() 2NO2(g),隨溫度升高,混合氣體的顏色變深。
2NO2(g),隨溫度升高,混合氣體的顏色變深。
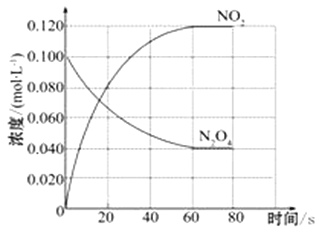
回答下列問題:
(1)反應的△H___________0(填“大于”“小于”);100℃時,體系中各物質濃度隨時間變化如上圖所示。在0~60s時段,反應速率v(N2O4)為_____________molL-1s-1,反應的平衡常數K1為______________。
(2)100℃時達到平衡后,改變反應溫度為T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,經10 s又達到平衡。
① T __________100℃(填“大于”“小于”),判斷理由是______________________________________;
② 溫度T時反應的平衡常數K2 為 ___________________。
(3)溫度T時反應達平衡后,將反應容器的容積減少一半,平衡向______________(填“正反應”或“逆反應”)方向移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)常溫下,0.05 mol/L的硫酸溶液的pH=___,水電離出的c(H+)=___mol/L。
(2)在常溫下,水電離出的c(H+)=1×10-13 mol·L-1的NaOH溶液中,pH=__________,c(NaOH)=_______mol·L-1。
(3)某溫度下,純水的c(H+)=2×10-7 mol·L-1,則此時純水的c(OH-)為________。若溫度不變,滴入稀鹽酸使c(H+)=5×10-4 mol·L-1,則溶液中c(OH-)為________,此時溫度________(填“高于”、“低于”或“等于”)25℃。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com