
【題目】氯堿工業中電解飽和食鹽水的原理示意圖如圖所示(電極均為石墨電極)。下列說法中正確的是( )

A. M為電子流出的一極
B. 通電使氯化鈉發生電離
C. 電解一段時間后,陰極區pH降低
D. 電解時用鹽酸調節陽極區的pH在2~3,有利于氣體逸出
【答案】D
【解析】
電解過程中陽離子向陰極移動,由圖可知,右側電極為陰極,則N為負極,左側電極為陽極,M為正極,結合電解原理分析解答。
A.由上述分析可知,N為負極,電子從負極流出,即N為電子流出的一極,故A錯誤;
B.氯化鈉在水溶液中發生電離,不需要通電,通電使氯化鈉溶液發生電解反應,故B錯誤;
C.電解時,陰極上氫離子得電子生成氫氣,同時生成氫氧根離子,溶液中氫氧根離子的濃度增大,則pH增大,故C錯誤;
D.電解時,陽極上氯離子失電子生成氯氣,用鹽酸控制陽極區溶液的pH在2~3的作用是促使化學平衡Cl2+H2OHCl+HClO向左移動,減少Cl2在水中的溶解,有利于Cl2的逸出,故D正確;
故選D。


科目:高中化學 來源: 題型:
【題目】如圖所示,組成一種原電池。試回答下列問題(燈泡功率合適):
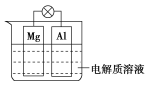
(1)電解質溶液為稀硫酸時,燈泡亮, Mg電極上發生的反應為____________;Al電極上發生的反應為________。溶液中![]() 向________移動(填“Mg電極”或“Al電極”)
向________移動(填“Mg電極”或“Al電極”)
(2)電解質溶液為NaOH溶液時,燈泡________(填“亮”或“不亮”,填“亮”做a題,填“不亮”做b題)。_______________
a.若燈泡亮,Al電極為_______________(填“正極”或“負極”)。
b.若燈泡不亮,其理由為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】屠呦呦率領團隊先后經歷了用水、乙醇、乙醚提取青蒿素的過程,最終確認只有采用低溫、乙醚冷浸等方法才能成功提取青蒿素。研究發現青蒿素中的某個基團對熱不穩定,該基團還能與NaI作用生成I2 。碳原子連有4個不同的原子或基團時,該碳稱為手性碳,下列分析不正確的是
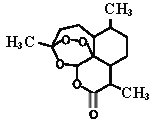
A. 推測青蒿素在乙醚中的溶解度大于在水中的溶解度
B. 青蒿素可以與NaOH、Na2CO3 、NaHCO3反應
C. 青蒿素分子中含有手性碳
D. 青蒿素中對熱不穩定且具有氧化性的基團是“-O-O-”
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組利用下面的裝置進行實驗,②、③中溶液均足量,操作和現象如下表。
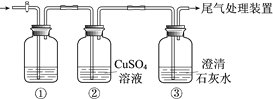
實驗 | 操作 | 現象 |
Ⅰ | 向盛有Na2S溶液的①中持續通入CO2至過量 | ②中產生黑色沉淀,溶液的pH降低; ③中產生白色渾濁,該渾濁遇酸冒氣泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持續通入H2S氣體至過量 | 現象同實驗Ⅰ |
資料:CaS遇水完全水解
由上述實驗得出的結論不正確的是
A. ③中白色渾濁是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 實驗Ⅰ①中CO2過量發生的反應是:CO2+H2O+ S2== CO32+ H2S
D. 由實驗Ⅰ和Ⅱ不能比較H2CO3和H2S酸性的強弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環氧樹脂因其具有良好的機械性能、絕緣性能以及與各種材料的粘結性能,已廣泛應用于涂料和膠黏劑等領域。下面是制備一種新型環氧樹脂G的合成路線:

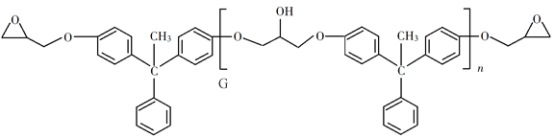
已知以下信息:
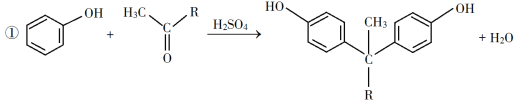

 回答下列問題:
回答下列問題:
(1)A是一種烯烴,化學名稱為__________,C中官能團的名稱為__________、__________。
(2)由B生成C的反應類型為__________。
(3)由C生成D的反應方程式為__________。
(4)E的結構簡式為__________。
(5)E的二氯代物有多種同分異構體,請寫出其中能同時滿足以下條件的芳香化合物的結構簡式__________、__________。
①能發生銀鏡反應;②核磁共振氫譜有三組峰,且峰面積比為3∶2∶1。
(6)假設化合物D、F和NaOH恰好完全反應生成1 mol單一聚合度的G,若生成的NaCl和H2O的總質量為765g,則G的n值理論上應等于__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應2SO2(g)+O2(g)![]() 2SO3(g)。在反應過程中某一時刻SO2、O2、SO3的濃度分別為0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。當反應達到平衡時,可能存在的數據是( )
2SO3(g)。在反應過程中某一時刻SO2、O2、SO3的濃度分別為0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。當反應達到平衡時,可能存在的數據是( )
A.SO2為0.4 mol·L-1,O2為0.2 mol·L-1B.SO2為0.35 mol·L-1
C.SO3為0.4 mol·L-1D.SO2、SO3均為0.15 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種生物電化學方法脫除水體中NH4+的原理如下圖所示:
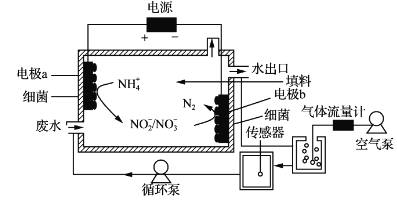
下列說法正確的是
A. 裝置工作時,化學能轉變為電能
B. 裝置工作時,a極周圍溶液pH降低
C. 裝置內工作溫度越高。NH4+脫除率一定越大
D. 電極b上發生的反應之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予鋰離子電池的發明者,鋰離子電池是目前應用廣泛的一類電池。以鈦鐵礦(主要成分為FeTiO3,含有少量MgO、Fe2O3、SiO2等雜質)為原料,制備鋰離子電池電極材料的工藝流程如圖所示:
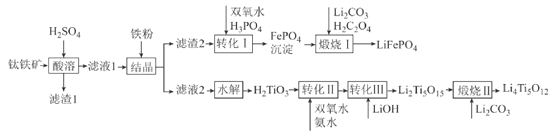
已知:①濾液1中含Ti微粒的主要存在形式為TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某離子濃度小于等于10-5mol·L-1時,認為該離子沉淀完全。
請回答下列問題:
(1)濾渣1中主要成分的化學式為__。
(2)“結晶”溫度需控制在70℃左右,若溫度過高會導致的后果為__。
(3)“轉化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,則溶液中c(PO43-)的范圍為__。
(4)“煅燒I”反應中氧化劑和還原劑的物質的量之比為__。
(5)“轉化II”中H2TiO3的轉化率(α)與溫度(T)的關系如圖所示。T0℃時,一定時間內H2TiO3的轉化率最高的原因為__。
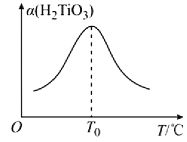
(6)Li2Ti5O15中-1價與-2價O原子的數目之比為___。“煅燒II”反應中同時生成兩種參與大氣循環的氣體,該反應的化學方程式為__。
(7)某鋰離子電池放電時的電池反應為Li1-xFePO4+LixC6=LiFePO4+6C,則充電時陽極的電極反應式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用氯氣和金屬鐵反應制備無水三氯化鐵,該化合物呈棕紅色、易潮解,受熱易升華。裝置如下:
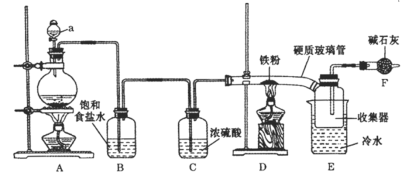
(1)儀器a的名稱是____________。
(2)A中反應的離子方程式是__________,D中反應的化學方程式是__________。
(3)反應開始時,先點燃____________處的酒精燈(填“A”或“D”)。
(4)若無B、C兩裝置,所得產物中可能含有的雜質是_____________(寫化學式)。
(5)F中堿石灰的作用是____________(寫2點)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com