
(15分)氨氣是一種重要的化工原料,大量用于制造尿素、純堿、銨態氮肥以及硝酸,在有機合成工業中制合成纖維、塑料、染料等。請回答下列問題:
(1)氨氣是工業制備硝酸的重要原料,已知下列三個熱化學方程式:
① N2 (g)+ 3H2
(g)  2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否應用△H1和△H2表示△H?
若能用△H1和△H2表示△H,則寫出△H= ;若不能,說明理由:
。
(2)在相同的溫度下,容積相等的兩個恒容密閉容器(編號分別為a和b)中,一定量的氮氣和氫氣發生下列可逆反應:
N2(g)
+ 3H2(g)
 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
實驗測得反應起始時各物質的物質的量及平衡時放出的熱量如下表:
|
容器編號 |
起始時各物質物質的量/mol |
平衡時反應 |
||
|
N2 |
H2 |
NH3 |
||
|
a |
1 |
3 |
0 |
23.1 |
|
b |
2 |
6 |
0 |
未知(用E表示) |
下列說法正確的是 (填序號)
① 反應a和反應b的氫氣轉化率相同
②利用已知數據可以計算反應b的平衡常數
③利用已知數據可以計算反應b放出的能量E
④平衡時a、b兩個反應的氨氣體積分數為1:1
(3)溫度為400℃、壓強為30Mpa的情況下,密閉容器中發生氫氣與氮氣的合成氨反應:N2(g)+3H2(g)  2NH3(g)
△H<0 。
2NH3(g)
△H<0 。
氨氣的物質的量[n(NH3)]和氫氣的物質的量[n(H2)]隨時間變化的關系如下圖:

正反應速率最大的點是 (選填a、b、c、d中的一個或幾個),氮氣的物質的量[n(N2)]相等的兩點是 (選填a、b、c、d中的兩個);保持其他條件不變,將溫度改為600℃,在上圖中畫出反應達到平衡的過程中氨氣的變化曲線。
(4)工業合成氨用煤制備原料氣氫氣時,往往排放大量的二氧化碳。實際工業生成中可利用二氧化碳聯合生產二甲醚(CH3OCH3),一定條件下,在容積固定的密閉設備中發生反應:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
兩個密閉恒容容器中在溫度均為T且保持不變的情況下進行上述反應,一段時間后測得兩個容器中有關數據及正逆反應速率關系如下表:
|
容器 |
c(CO2) /mol·L-1 |
c(H2) /mol·L-1 |
c(CH3OCH3) /mol·L-1 |
c(H2O) /mol·L-1 |
v (正)和v (逆)比較 |
|
容器I |
1.0×10-2 |
1.0×10-2 |
1.0×10-4 |
1.0×10-4 |
v (正)=v (逆) |
|
容器II |
2.0×10-2 |
1.0×10-2 |
1.0×10-4 |
2.0×10-4 |
|
容器I中的反應 (選填“是”或“否”)達到平衡狀態,該反應在溫度為T時的平衡常數K= 。表格內的空格處v(正)與v(逆)的大小關系是 。
(1)不能,缺少氫氣的燃燒熱 (2分)
(2)②③ (2分)
(3)a (2分)
cd (2分) 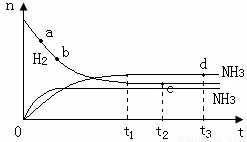 (2分)
(2分)
(4)是 (1分) 1.0 (3分) v(正)<v(逆) (1分)
【解析】(1)根據蓋斯定律可知,反應①②無法得到反應③,因為缺少氫氣的燃燒熱。
(2)容器b相當于在容器a的基礎上增大壓強,平衡向正反應方向移動,所以b中轉化率高,①、④不正確。根據a中放出的熱量可以得出該溫度下的平衡常數。又因為ab中溫度相同,平衡常數相同,所以能計算出b中放出的熱量,因此②③正確,答案選②③。
(3)反應物的濃度越大,正反應速率越大,開始階段反應物的濃度越大,所以答案選a點。Cd兩點屬于平衡狀態,氮氣的物質的量相同。應用正反應是放熱反應,所以升高溫度,反應速率都是增大的,但平衡時氨氣的濃度是減小的,所以圖像為(見答案)。
(4)容器1中正逆反應速率是相等的,所以反應處于平衡狀態。根據平衡時物質的濃度可知,平衡常數是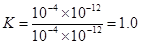 。根據表中數據可知
。根據表中數據可知 >1,所以正反應速率小于逆反應速率。
>1,所以正反應速率小于逆反應速率。


科目:高中化學 來源: 題型:閱讀理解
 氨氣是一種重要的化工原料,但隨著工業化進程的加快,氨氣也逐漸變成居室里一種重要的污染性氣體.
氨氣是一種重要的化工原料,但隨著工業化進程的加快,氨氣也逐漸變成居室里一種重要的污染性氣體.
| ||
| ||
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 氨氣是一種重要的化工原料.完成下列填空:
氨氣是一種重要的化工原料.完成下列填空:查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 一定條件 |
| 時間/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
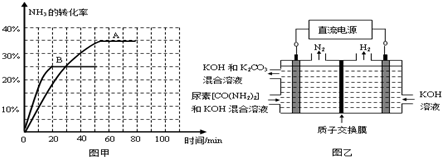
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com