
【題目】BHT是一種常用的食品抗氧化劑,由對甲基苯酚(![]() )合成BHT的常用方法有2種(如圖),下列說法不正確的是
)合成BHT的常用方法有2種(如圖),下列說法不正確的是

A. BHT能使酸性KMnO4溶液褪色
B. BHT與對甲基苯酚互為同系物
C. BHT中加入濃溴水易發生取代反應
D. 方法一的原子利用率高于方法二
科目:高中化學 來源: 題型:
【題目】物質分類和實驗探究都是中學化學重要的學科思想。
(一)以下是對“一些物質與水反應”的分類圖,請按要求填空:

上述分類方法是______;A組物質中屬于電解質的是_____(填化學式);C組物質與水反應的離子方程式為_____;D組物質與水反應中,氧化劑和還原劑物質的量之比為1∶2的物質是___(填化學式)。
(二)用質量分數為98%的濃硫酸(密度為1.84 g·cm3)配制240 mL濃度為0.5 mol·L-1的硫酸溶液,選用到的儀器正確的是______(填序號)。

下列操作會使配制結果偏高的是_______(填序號)
A 容量瓶用蒸餾水洗凈后,未進行干燥處理
B 稀釋的硫酸轉移到容量瓶中后未洗滌燒杯
C 未冷卻,即將溶液注入容量瓶并定容
D定容時,俯視容量瓶的刻度線
(三)某小組用如下裝置比較氯、溴、碘的非金屬性強弱實驗(夾持儀器已略去,氣密性已檢驗)。

實驗步驟:
①打開彈簧夾,打開活塞a,滴加濃鹽酸;
②當B和C中的溶液都變為黃色時,夾緊彈簧夾;
③當B中溶液由黃色變為棕紅色時,關閉活塞a;
④打開活塞b,將少量C中溶液滴入試管D中,關閉活塞b,取下試管D振蕩,靜置后CCl4層變為紫紅色。
請回答:
(1)裝置A中證明氯的非金屬性強于碘的實驗現象是_________。
(2)B中溶液發生反應的離子方程式是_______________。
(3)步驟③實驗的目的是確認C的黃色溶液中無_____(填化學式)。步驟④能否說明非金屬性:Br>I_______(填“能”或“否”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.離子鍵就是陰、陽離子間的靜電引力和靜電斥力
B.所有金屬元素與所有非金屬元素間都能形成離子鍵
C.鈉原子與氯原子結合形成離子鍵
D.在離子化合物 CaCl2 中,兩個氯離子間也存在離子鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知丙酮(C3H6O)通常是無色液體,可溶于水,密度小于1 g·mL-1,沸點約為56 ℃。要將丙酮從水與丙酮的混合物中分離出來,最合理的方法選擇是( )
A. 過濾 B. 蒸餾 C. 蒸發 D. 干燥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料,又可作為燃料。利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發生的主反應如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列問題:
(1)已知反應①中的相關的化學鍵鍵能數據如下:
化學鍵 | H—H | C—O | C←=O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
已知ΔH2=-58 kJ·mol-1,由此計算ΔH3=________kJ·mol-1。
(2)圖1中能正確反映平衡常數K隨溫度變化關系的曲線為________(填曲線標記字母),其判斷理由是___________________________________________________。
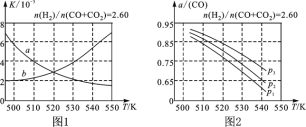
(3)合成氣的組成n(H2)/n(CO+CO2)=2.60時,體系中的CO平衡轉化率(α)與溫度和壓強的關系如圖2所示。α(CO)值隨溫度升高而________(填“增大”或“減小”),其原因是______________________________________________________。圖2中的壓強由大到小為__________,其判斷理由是___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用平衡移動原理解釋的是
|
|
|
|
A.開啟啤酒瓶后,瓶中馬上泛起大量泡沫 | B.由I2(g)、I2(g)、HI(g)組成的平衡體系加壓后顏色變深 | C.實驗室制取乙酸乙酯時,將乙酸乙酯不斷蒸出 | D.石灰巖受地下水長期溶蝕形成溶洞 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)寫出下列物質電離方程式:
Na2CO3__________________;
NH3·H2O_________________;
(2)寫出下列物質水解的離子方程式:
NaHCO3__________________;
FeCl3___________________;
(3)常溫時,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等體積混合,求混合溶液的pH為_______。
(4)用pH試紙測定溶液pH的操作是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列化學反應方程式:
(1)乙醇催化氧化:_____;
(2)苯與濃硝酸、濃硫酸共熱:_____;
(3)硬脂酸甘油脂的皂化反應:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列屬于氧化還原反應,且為吸熱反應的是 ( )
A.C+H2O![]() CO+H2B.2NaOH+H2SO4=Na2SO4+2H2O
CO+H2B.2NaOH+H2SO4=Na2SO4+2H2O
C.Zn+2H+=Zn2++H2↑D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com