
在下列各溶液中,離子一定能大量共存的是
A.強酸性溶液中:K+、Al3+、CH3COO-、SO42-
B.水電離出來的c(H+)=10-13mol/L的溶液:K+、HCO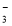 、Br-、Ba2+
、Br-、Ba2+
C.室溫下,pH=1的無色溶液中:NH4+、Mg2+、SO42-、Cl-
D.室溫下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
科目:高中化學 來源:2015屆福建省龍巖市高二第一學期教學質量檢測化學試卷(解析版) 題型:填空題
工業上常常利用反應①來生產環氧乙烷,但是伴隨副反應②。
①C2H4(g)+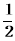 O2(g) →
O2(g) →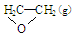 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
(1)寫出環氧乙烷充分燃燒的熱化學反應方程式。答:____________________________;
(2)工業生產中,可通過某一措施來加快反應①而對反應②影響較小,從而提高環氧乙烷的生產效率。工業生產采取的這種措施是_______________。
A.升高反應體系的溫度B.增大體系中氧氣的濃度
C.使用合適的催化劑D.降低反應體系的壓強
(3)已知C=C、O=O、C—C鍵能分別為a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,則環氧乙烷中C—O鍵能為 kJ·mol-1;
(4)反應②可以設計成燃料電池,若以酸做電解質溶液,負極反應式是 。
查看答案和解析>>
科目:高中化學 來源:2015屆湖南省益陽市高二下學期第一次月考化學試卷(解析版) 題型:選擇題
25℃和101kPa時,乙烷、乙炔和丙烯組成的混合烴8mL,與過量氧氣混合并完全燃燒,除去水蒸氣,恢復到原來的溫度和壓強,氣體總體積縮小了18mL,原混合烴中乙炔的體積分數為( )
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省黃石市高二上學期期末考試化學試卷(解析版) 題型:填空題
鐵和鐵的化合物用途廣泛。請回答下列問題:
(1)寫出在潮濕空氣中鋼鐵銹蝕時正極反應的電極反應式:_______________________。
將生銹的鐵屑放入H2SO4溶液中充分溶解后,在溶液中并未檢測出Fe3+,用離子方程式說明原因:______________________________________。
(2)愛迪生蓄電池的反應式為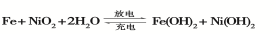
①愛迪生蓄電池的正極是 , 該電池工作一段時間后必須充電,充電時生成Fe的反應類型是______。
②高鐵酸鈉(Na2FeO4)是一種新型凈水劑。用如圖裝置可以制取少量高鐵酸鈉。寫出在用電解法制取高鐵酸鈉時,陽極的電極反應式___________________________________。
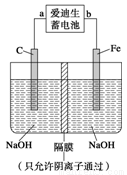
③你認為高鐵酸鈉作為一種新型凈水劑的理由錯誤的是 ______。
a.高鐵酸鈉溶于水形成一種膠體,具有較強的吸附性
b.高鐵酸鈉在消毒殺菌時被還原生成Fe3+,Fe3+水解產生氫氧化鐵膠體能吸附懸浮雜質
c.高鐵酸鈉具有強氧化性,能消毒殺菌
d.高鐵酸鈉具有強還原性,能消毒殺菌
(3)某FeO、Fe2O3混合物中,鐵、氧的物質的量之比為4︰5,其中Fe2+與Fe3+物質的量之比為___________。
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省黃石市高二上學期期末考試化學試卷(解析版) 題型:選擇題
在密閉容器中,使2 mol N2和6 mol H2混合發生下列反應:N2(g)+3H2(g)  2NH3(g)(正反應為放熱反應)。下列說法錯誤的是
2NH3(g)(正反應為放熱反應)。下列說法錯誤的是
A.升高平衡體系的溫度(保持體積不變),混合氣體的平均相對分子質量變大
B.升高平衡體系的溫度(保持體積不變),混合氣體的密度不變
C.當反應達到平衡時,N2和H2的濃度比是 1∶3
D.當達到平衡時,充入氬氣,并保持壓強不變,平衡將逆向移動
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省黃石市高二上學期期末考試化學試卷(解析版) 題型:選擇題
對于可逆反應:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低溫度產生的影響為
2SO3(g) ΔH<0,降低溫度產生的影響為
A.v正 增大,v逆減小 B.v正減小,v逆增大
C.v正和v逆同程度的減小 D.v正和v逆不同等程度的減小
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省高二上學期期末考試化學試卷(解析版) 題型:填空題
如圖是8種有機化合物的轉換關系:
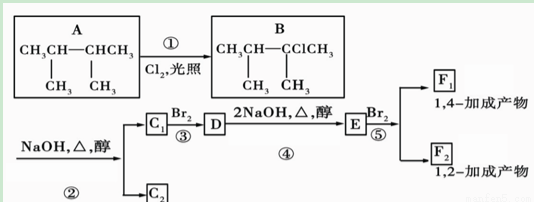
請回答下列問題:
(1)根據系統命名法,化合物A的名稱是________。
(2)上述框圖中,①是______反應,③是______反應(填反應類型)。
(3)化合物E是重要的工業原料,寫出由D生成E的化學方程式:________________________。
(4)C1的結構簡式是____________ __;F1的結構簡式是__ __________ ___。F1與F2的關系為________。
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省高二上學期期末考試化學試卷(解析版) 題型:選擇題
下列對化學平衡移動的分析中,不正確的是
①已達平衡的反應C(s)+H2O(g) CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
②已達平衡的反應N2(g)+3H2(g) 2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高
2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密閉容器中,發生反應:PCl3(g)+ Cl2(g) PCl5(g)達平衡時,PCl5為0.4mol,如果此時移走1.0 molPCl3 和0.50 molCl2,在相同溫度下再達平衡時PCl5的物質的量應大于0.20mol而小于0.40mol
PCl5(g)達平衡時,PCl5為0.4mol,如果此時移走1.0 molPCl3 和0.50 molCl2,在相同溫度下再達平衡時PCl5的物質的量應大于0.20mol而小于0.40mol
④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡不會發生移動
A.①④ B.①②③ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省荊門市高二上學期期末考試化學試卷(解析版) 題型:選擇題
汽車等機動車輛的啟動電源常用鉛蓄電池,放電時的電池反應如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根據此反應判斷下列敘述中正確的是
A.Pb02是電池的負極
B.負極的電極反應式為:Pb+SO42--2e-=PbSO4
C.PbO2得電子,被氧化
D.電池放電時,溶液酸性增強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com