
【題目】下列關于晶體的說法正確的組合是( )
①分子晶體中都存在共價鍵
②在晶體中只要有陽離子就一定有陰離子
③金剛石、SiC、NaF、NaCl、H2O、H2S晶體的熔點依次降低
④離子晶體中只有離子鍵沒有共價鍵,分子晶體中肯定沒有離子鍵
⑤CaTiO3晶體中(晶胞結構如圖所示)每個鈦原子和12個氧原子緊相鄰

⑥SiO2晶體中每個硅原子與兩個氧原子以共價鍵相結合
⑦晶體中分子間作用力越大,分子越穩(wěn)定
⑧氯化鈉熔化時離子鍵被破壞
A.①②③⑥B.①②④C.③⑤⑦D.③⑤⑧
【答案】D
【解析】
①稀有氣體是單原子分子,不存在共價鍵,故①錯誤;
②金屬晶體由金屬陽離子和自由電子組成,無陰離子,故②錯誤;
③晶體中熔點高低一般順序是:原子晶體>離子晶體>分子晶體;在原子晶體中,原子半徑越大熔點越低;在離子晶體中,離子半徑越大,熔點越低,電荷越多,熔點越高;在分子晶體中,相對分子質(zhì)量越大,熔點越高(含有氫鍵的物質(zhì)除外),所以這幾種物質(zhì)的熔點高低順序是金剛石、SiC、NaF、NaCl、H2O、H2S。故③正確;
④離子晶體中可能有共價鍵,如氯化銨中氮氫鍵屬于共價鍵,分子晶體中肯定沒有離子鍵,故④錯誤;
⑤由晶胞結構可知CaTiO3,晶體中Ti的配位數(shù)為12,所以每個Ti4+和12個O2-緊鄰,故⑤正確;
⑥SiO2晶體中每個硅原子與4個氧原子以共價鍵相結合,故⑥錯誤;
⑦分子穩(wěn)定性與分子內(nèi)共價鍵的強弱有關,與分子間作用力無關,故⑦錯誤;
⑧離子晶體熔化時離子鍵被破壞,氯化鈉是離子晶體,故⑧正確,
故正確序號為③⑤⑧綜上所述,正確答案為D。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】一定溫度下,向1.0L的密閉容器中加入0.60molX(g),發(fā)生反應X(g)![]() Y(s)+2Z(g),測得反應物X的濃度與反應時間的關系如表所示:
Y(s)+2Z(g),測得反應物X的濃度與反應時間的關系如表所示:
反應時間t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)0~3min內(nèi)用Z表示的平均反應速度v(Z)=___。
(2)分析該反應中反應物的濃度與時間的關系,得出的結論是___。由此規(guī)律推出在6min時反應物X的濃度為___mol·L-1。
(3)該反應的逆反應速率隨時間變化的曲線如圖所示,t2時改變的條件可能是___、___。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是自然界碳循環(huán)中的重要物質(zhì)。下列過程會引起大氣中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃燒 D. 碳酸鹽的沉積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬是一種過渡金屬元素,其單質(zhì)通常用作合金及不銹鋼的添加劑,這種金屬可增強合金的強度、硬度、可焊性及韌性,還可增強其耐高溫及耐腐蝕性能。下圖是化工生產(chǎn)中制備金屬鉬的主要流程:

(1)用簡單氧化物形式表示![]() 的組成:____________________________。
的組成:____________________________。
(2)寫出反應①的化學方程式:______________________。
(3)反應①的尾氣可以再利用,寫出兩種利用該尾氣制得的化學藥品:______________________。
(4)工業(yè)上制備還原性氣體的反應原理有: ,
, 。將含甲烷體積分數(shù)為80%的a L(標準狀況下)天然氣與足量二氧化碳和水蒸氣混合物在高溫下反應,甲烷的轉化率為90%,用產(chǎn)生的還原性氣體(
。將含甲烷體積分數(shù)為80%的a L(標準狀況下)天然氣與足量二氧化碳和水蒸氣混合物在高溫下反應,甲烷的轉化率為90%,用產(chǎn)生的還原性氣體(![]() 和
和![]() )依據(jù)反應⑤冶煉鉬,理論上生成鉬的質(zhì)量為___________(已知
)依據(jù)反應⑤冶煉鉬,理論上生成鉬的質(zhì)量為___________(已知![]() 的相對原子質(zhì)量為96)
的相對原子質(zhì)量為96)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關。下列說法錯誤的是
A. PM2.5是指粒徑不大于2.5μm的可吸入懸浮顆粒物
B. 綠色化學要求從源頭上消除或減少生產(chǎn)活動對環(huán)境的污染
C. 燃煤中加入CaO可以減少酸雨的形成及溫室氣體的排放
D. 天然氣和液化石油氣是我國目前推廣使用的清潔燃料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A,B,C,D是四種短周期元素,E是過渡元素。A,B,C同周期,C,D同主族,A的原子結構示意圖為 ,B是同周期第一電離能最小的元素,C的最外層有三個未成對電子,E的外圍電子排布式為3d64s2。試回答下列問題:
,B是同周期第一電離能最小的元素,C的最外層有三個未成對電子,E的外圍電子排布式為3d64s2。試回答下列問題:
(1)寫出下列元素的符號:A__________,B__________,C__________,D__________。
(2)用化學式表示上述五種元素中最高價氧化物對應水化物酸性最強的是________,堿性最強的是__________。
(3)用元素符號表示D所在周期第一電離能最大的元素是________,電負性最大的元素是__________。
(4)E元素原子的核電荷數(shù)是__________,E元素在周期表的第________周期第________族,已知元素周期表可按電子排布分為s區(qū)、p區(qū)等,則E元素在________區(qū)。
(5)寫出D元素原子構成單質(zhì)的電子式__________,該分子中有____個σ鍵,____個π鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化錳不僅是活性好的催化劑,也被廣泛用作干電池的正極材料。某化學小組設計用高硫錳礦(主要成分為錳的化合物和硫化亞鐵)為原料制取二氧化錳的工藝流程如圖:
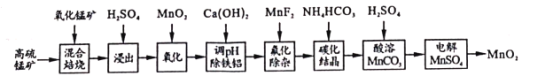
已知:①“混合焙燒”后的燒渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在該條件下,金屬離子開始沉淀和完全沉淀的pH如表:
金屬離子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
開始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)寫出浸出時與鋁元素有關的離子反應方程式____。
(2)上述“氧化”步驟是否可省略____(填“是”或“否”),你的依據(jù)是 _____。
(3)“調(diào)pH除鐵鋁’’時,生成沉淀的pH范圍為____;“氟化除雜”中除去的離子為____。
(4)請用平衡移動原理解釋除雜處理后的Mn2+用NH4HCO3轉化成MnCO3沉淀的過程___(用文字和離子方程式表達)。
(5)用惰性電極電解MnSO4制備MnO2時,其陽極反應式為____;整個流程中能夠循環(huán)利用的物質(zhì)除MnO2外還有___(寫名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質(zhì)溶液的說法正確的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 減小
減小
B.將CH3COONa溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C.向鹽酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的飽和溶液中加入少量AgNO3,溶液中![]() 不變
不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某容器中發(fā)生一個化學反應,反應過程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六種離子。在反應過程中測得ClO-和N2的物質(zhì)的量隨時間變化的曲線如圖所示。下列有關判斷中不正確的是

A.還原劑是含CN-的物質(zhì),氧化產(chǎn)物不只有N2
B.氧化劑是ClO-,還原產(chǎn)物是HCO3-
C.參與反應的氧化劑與還原劑的物質(zhì)的量之比為2:5
D.標準狀況下若生成2.24LN2則轉移電子為1mol
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com