
(12分)下圖表示各物質之間的轉化關系。已知:常溫下B、D、F、G、I、J是氣體, F、G是空氣中的主要成分,D是一種堿性氣體。A中陰、陽離子個數比是1∶1, E是一種黑色氧化物,H是紫紅色金屬單質。(部分生成物和反應條件省略)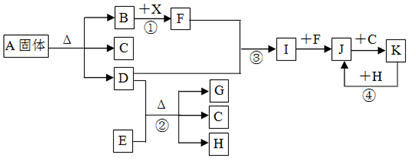
請按要求填空:
(1)A物質的化學式是 ;
(2)反應③的化學方程式是 ;
反應④的離子方程式是 ;
(3)反應①中產生標準狀況下1.12L氣體F,則轉移的電子數目是 ;
(4)檢驗溶液A中陽離子的方法是
;
(5)反應②中氧化劑是 ;
(1)NH4HCO3
(2)4NH3+5O2  4NO+6H2O Cu+4H++2NO3-===Cu2++2 NO2↑+2H2O
4NO+6H2O Cu+4H++2NO3-===Cu2++2 NO2↑+2H2O
(3)6.02×1022
(4)取少許溶液A于試管,加入NaOH溶液,微熱,能產生使濕潤的紅色石蕊試紙變藍的氣體,則說明有NH4+。 (5)CuO (每空2分)
解析試題分析:常溫下B、D、F、G、I、J是氣體,F、G是空氣中的主要成分,分別為氧氣、氮氣中的一種,D是一種堿性氣體,則D為NH3,E是一種黑色氧化物,H是紫紅色金屬單質,結合轉化關系②可知,E為CuO、H為Cu,G為N2、C為H2O,故F為O2,由F與D得到I、I能與F繼續反應生成J,則I為NO、J為NO2,J與C(H2O)反應生成K,K與H(Cu)反應得到二氧化氮,則K為HNO3,固體A分解得到氨氣、水與氣體B,B能與X反應得到F(氧氣),則B為CO2,X為Na2O2;
⑴A中陰、陽離子個數比是1:1,故A為NH4HCO3;
⑵通過由上述分析可知,反應③的化學方程式是4NH3+5O2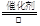 4NO+6H2O;反應④的離子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
4NO+6H2O;反應④的離子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
⑶反應①為2CO2+2Na2O2=2Na2CO3+O2,產生標準狀況下1.12L氧氣,其物質的量=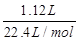 =0.05mol,反應中氧元素由-1價升高為氧氣中0價,轉移電子的物質的量為0.05mol×2×[0-(-1)]=0.1mol,轉移電子數為6.02×1022;
=0.05mol,反應中氧元素由-1價升高為氧氣中0價,轉移電子的物質的量為0.05mol×2×[0-(-1)]=0.1mol,轉移電子數為6.02×1022;
⑷溶液A中陽離子為NH4+,檢驗NH4+的方法是:取少許溶液A于試管,加入NaOH溶液,微熱,能產生使濕潤的紅色石蕊試紙變藍的氣體,則說明有NH4+;
⑸反應②是氨氣與CuO反應生成氮氣、Cu與水,反應中CuO轉化Cu元素化合價由+2降低為0價,故CuO是氧化劑。
考點:考查無機框圖推斷。


 開心蛙狀元測試卷系列答案
開心蛙狀元測試卷系列答案科目:高中化學 來源: 題型:單選題
下列說法正確的是
①氯氣的性質活潑,它與氫氣混合后立即發生爆炸
②實驗室制取氯氣時,為了防止環境污染,多余的氯氣可以用氫氧化鈣溶液吸收
③新制氯水的氧化性強于久置氯水
④檢驗HCl氣體中是否混有Cl2方法是將氣體通入硝酸銀溶液
⑤除去HCl氣體中的Cl2,可將氣體通入飽和食鹽水
| A.①②③ | B.②③④ | C.③ | D.③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某化學小組用下圖所示裝置制取氯氣,下列說法不正確的是
| A.該裝置圖中至少存在兩處明顯錯誤 |
| B.燒瓶中的MnO2可換成KMnO4 |
| C.在乙后連一盛有飽和食鹽水的燒杯可進行尾氣處理 |
| D.在集氣瓶的導管口處放一片濕潤的淀粉碘化鉀試紙可以證明是否有氯氣逸出 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
疊氮酸鈉(NaN3)是無色離子晶體,遇高溫或劇烈震動能發生強烈爆炸,快速分解成鈉單質和氮氣,是汽車安全氣囊中的成分之一。下列有關說法正確的是
| A.NaN3中只含有離子鍵 |
| B.1molNaN3完全分解最多可以產生33.6LN2 |
| C.NaN3快速分解時,NaN3既是氧化劑,又是還原劑 |
| D.常溫下,NaN3化學性質穩定,包裝盒上無需特別說明注意事項 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關氯氣的敘述中不正確的是( )
| A.氯氣是一種黃綠色,有刺激性氣味的氣體 |
| B.氯氣,液氯,氯水是同一種物質 |
| C.氯氣能溶于水 |
| D.氯氣是一種有毒氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在KBr和KI的混合液中通入過量的Cl2,除了水分子外,溶液中主要有 ______分子,若把溶液蒸干得到固體灼燒后還剩下 ____________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)在下圖所示的物質轉化關系中(部分反應條件及產物省略),化合物A由短周期元素組成,B是常見的無色液體,C是能使濕潤的紅色石蕊試紙變藍色的氣體,E是淡黃色粉末,D、F、G均為無色氣體。
完成下列問題:
(1)寫出A的化學式 。
(2)組成F的元素在周期表中位于 周期 族。
(3)B的電子式是 。
(4)反應①的化學方程式: 。
(5)反應②的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(17分)Na2SO3固體在空氣中久置容易變質 。
(I)Na2SO3固體在空氣中變質的主要原因,用化學方程式表示為 。
(II)為探究Na2SO3樣品的變質情況,現提出以下假設:
假設1:Na2SO3樣品完全變質; 假設2:Na2SO3樣品完全沒有變質;假設3: 。
補充完成以下實驗過程及現象和結論,完成探究。
| 實驗操作 | 現象和結論 |
| 步驟1:取少許樣品于試管中,加入適量蒸餾水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 現象:若KMnO4溶液的紫紅色褪為無色 ①結論:樣品中有 離子,假設1不成立。 ②褪色的離子方程式為: 。 |
| 步驟2:另取少許樣品于試管中,加入適量蒸餾水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加適量BaCl2溶液; | ③現象:若 ; 結論:假設2成立。 |
| …… | …… |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
亞氯酸鈉(NaClO2)是一種強氧化性漂白劑,廣泛用于紡織、印染和食品工業。它在堿性環境中穩定存在。工業設計生產NaClO2的主要流程如下: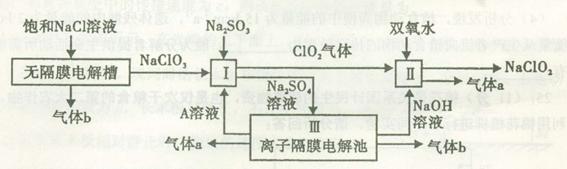
(1)A的化學式是 ,裝置III中A在 極區產生。
(2)II中反應的離子方程式是 。
(3)通電電解前,檢驗III中陰離子的方法和步驟是 。
(4)為防止II中制備的NaClO2被還原成NaCl,應選合適的還原劑,除雙氧水外,還可以選擇的還原劑是 (填字母編號)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常溫時,HClO2的電離平衡常數Ka=1.07 10-2mol·L-1,II中反應所得NaClO2溶液(含少量NaOH)的pH=13,則溶液中
10-2mol·L-1,II中反應所得NaClO2溶液(含少量NaOH)的pH=13,則溶液中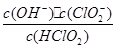 = 。
= 。
(6)氣體a、b與氫氧化鈉溶液可構成燃料電池,用該電池電解200 mL 0.5 mol·L-1的CuSO4溶液,生成銅3.2 g,此時所得溶液中離子濃度由大到小的順序是
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com