
【題目】已知A是一種不溶于水的固體非金屬氧化物,根據圖中的轉化關系,回答下列問題:
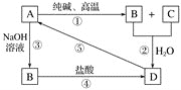
(1)寫出化學式:A是____________,D是____________。
(2)寫出相關反應的化學方程式:①____________,⑤____________。
(3)寫出相關反應的離子方程式:②__________,③__________,④__________。
【答案】SiO2 H2SiO3 Na2CO3+SiO2![]() Na2SiO3+CO2↑ H2SiO3
Na2SiO3+CO2↑ H2SiO3![]() H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
【解析】
A是一種不溶于水的固體非金屬氧化物,且A能夠與純堿(Na2CO3)、NaOH反應,A應該為SiO2;由轉化關系可知B為Na2SiO3,C為CO2,D為H2SiO3,據此進行解答。
A是一種不溶于水的固體非金屬氧化物,且A能夠與純堿(Na2CO3)、NaOH反應,A應該為SiO2;由轉化關系可知B為Na2SiO3,C為CO2,D為H2SiO3,③為SiO2和NaOH的反應,Na2SiO3可與酸反應生成硅酸,硅酸加熱分解生成二氧化硅,則
(1)由以上分析可知:A為SiO2,D為H2SiO3;
(2)①是SiO2和碳酸鈉在高溫下反應生成硅酸鈉和二氧化碳,反應的方程式為Na2CO3+SiO2![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
⑤是硅酸加熱分解生成二氧化硅,反應的化學方程式為H2SiO3![]() H2O+SiO2;
H2O+SiO2;
(3)②硅酸酸性比碳酸弱,硅酸鈉和二氧化碳、水反應可生成硅酸,反應的離子方程式為CO2+H2O+SiO32-=CO32-+H2SiO3↓;
③是二氧化硅和氫氧化鈉反應生成硅酸鈉和水,反應的離子方程式為SiO2+2OH-=SiO32-+H2O;
④是硅酸鈉和鹽酸反應生成硅酸,反應的離子方程式為SiO32-+2H+=H2SiO3↓。


 口算能手系列答案
口算能手系列答案科目:高中化學 來源: 題型:
【題目】Na2CO3俗名純堿,下面是對純堿采用不同分類法的分類,不正確的是( )
A.Na2CO3是氧化物B.Na2CO3是鹽
C.Na2CO3是鈉鹽D.Na2CO3是碳酸鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列三種溶液:①45%的乙醇溶液、②汽油和氯化鉀溶液、③氯化鈉和單質碘的水溶液,分離上述各組混合液的正確方法依次是( )
A.分液、萃取、蒸餾B.萃取、蒸餾、分液
C.分液、蒸餾、萃取D.蒸餾、分液、萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞砷酸(H3AsO3)可用于治療白血病,在溶液中存在多種微粒形態。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各種微粒物質的量分數與溶液的pH關系如下圖所示。下列說法正確的是( )

A. H3AsO3的電離常數Ka1的數量級為10-9
B. pH在8.0~10.0時,反應的離子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M點對應的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12時,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分。表中所列的字母分別代表一種化學元素。

試回答下列問題:
(1)I的最高化合價為__________,K的元素名稱為__________。
(2)寫出基態時Q元素原子的電子排布式__________,J元素原子的外圍電子排布式________________。
(3)下列對比正確的是__________。
a.原子半徑H>G>B>A
b.第一電離能E>D>C>B
c.電負性A>H>G>Q
d.最高價氧化物的水化物酸性B>A>H>G
(4)下列關于元素在元素周期表中的位置以及元素原子的外圍電子排布特點的有關敘述不正確的是__________。
a.L位于元素周期表第五周期ⅠA族,屬于s區元素
b.O位于元素周期表第七周期Ⅷ族,屬于ds區元素
c.M的外圍電子排布式為6s1,屬于ds區元素
d.H所在族的外圍電子排布式為ns2np2,屬于p區元素
【答案】 +6 銅 1s22s22p63s23p63d104s24p1 3d64s2 cd bc
【解析】試題分析:(1)I是Cr元素,價電子排布是3d54s1;K是29號元素Cu;(2)Q是31號元素Ga;(3)電子層數越多半徑越大,電子層數相同時,質子數越多半徑越小;同周期元素從左到右第一電離能增大,N元素2p能級為半充滿狀態,第一電離能大于相鄰的O元素;同周期元素從左到右電負性增強,同主族元素從上到下電負性減小;非金屬性越強,最高價氧化物的水化物酸性越強;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,價電子排布是5S1;Ⅷ族的元素,屬于d區元素;M的外圍電子排布式為5d106s1;H所在族的位ⅣA族,外圍電子排布式為ns2np2,屬于p區元素;
解析:(1)I是Cr元素,價電子排布是3d54s1,所以最高化合價為+6;K是29號元素Cu,名稱是銅;(2)Q是31號元素Ga,核外電子排布式是1s22s22p63s23p63d104s24p1;(3)電子層數越多半徑越大,電子層數相同時,質子數越多半徑越小,原子半徑G>H>A>B,故a錯誤;同周期元素從左到右第一電離能增大,N元素2p能級為半充滿狀態,第一電離能大于相鄰的O元素,所以第一電離能Ne>F>N>O,故b錯誤;同周期元素從左到右電負性增強,同主族元素從上到下電負性減小,所以電負性A>H>G>Q,故c正確;非金屬性越強,最高價氧化物的水化物酸性越強,最高價氧化物的水化物酸性HNO3>H2CO3>H2SiO3>Al(OH)3,故d正確;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,價電子排布是5S1,屬于s區元素,故a正確;Ⅷ族的元素,屬于d區元素,O位于元素周期表第七周期Ⅷ族,屬于d區元素,故b錯誤;M的外圍電子排布式為5d106s1,故c錯誤;H所在族的位ⅣA族,外圍電子排布式為ns2np2,屬于p區元素,故d正確。
點睛:同周期元素從左到右第一電離能增大,ⅤA族元素p能級為半充滿狀態,能量低,第一電離能大于相鄰的ⅥA族元素,如第二周期的N元素第一電離能大于O。
【題型】綜合題
【結束】
23
【題目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它們的原子序數依次增大。A是周期表中原子半徑最小的元素,D3B中陰、陽離子具有相同的電子層結構,B、C均可分別與A形成10個電子分子,B、C屬同一周期,兩者可以形成許多種共價化合物,C、F屬同一主族,B原子最外電子層的p能級上的電子處于半滿狀態,C的最外層電子數是內層電子數的3倍,E最外層電子數比最內層多1。請用具體的元素回答下列問題:
(1)E元素原子基態電子排布式 。
(2)用電子排布圖表示F元素原子的價電子構型 。
(3)F、G元素對應的最高價含氧酸中酸性較強的分子式為 。
(4)離子半徑D+ B3—,第一電離能B C,電負性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一種綠色氧化劑X有廣泛應用,X分子中A、C原子個數比1∶1,X的電子式為 ,試寫出Cu、稀H2SO4與X反應制備硫酸銅的離子方程式 。
(6)寫出E與D的最高價氧化物對應的水化物反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水合肼(N2H4·H2O)是無色、有強還原性的液體,實驗室制備水合肼的原理為:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl據此,某學生設計了下列實驗。
【制備NaClO溶液】實驗裝置如下圖圖甲所示(部分夾持裝置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
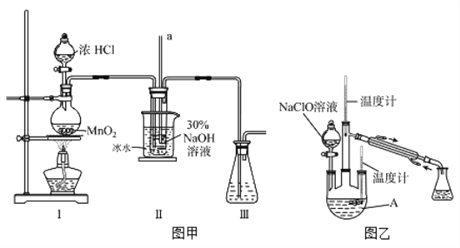
(1)配制30 %NaOH溶液時,所需玻璃儀器除量筒外還有__________(填字母)。
A.容量瓶 B.燒杯 C.移液管 D.玻璃棒
(2)裝置I中發生的離子反應方程式是_______________;Ⅱ中玻璃管a的作用為____________;Ⅱ中用冰水浴控制溫度在30℃以下,其主要目的___________________
【制取水合肼】實驗裝置如上圖圖乙所示
(3)反應過程中,如果分液漏斗中溶液的滴速過快, 部分N2H4·H2O參與A中反應并產生大量氮氣,產品產率因此降低,請寫出降低產率的相關化學反應方程式____________________;充分反應后,加熱蒸餾A內的溶液即可得到水合肼的粗產品。
【測定肼的含量】
(4)稱取餾分0.3000 g,加水配成20.0 mL溶液,一定條件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定時,可以選用的指示劑為____________;
②實驗測得消耗I2溶液的平均值為20. 00 mL,餾分中N2H4·H2O的質量分數為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為1120mL的燒瓶里充滿NO2和O2的混合氣體,然后將其倒扣于水槽中,可以看到液體充滿燒瓶(氣體體積已折算成標況下的體積),下列說法正確的是
A. NO2與O2的體積分別為896mL和224mL
B. 總反應式:NO2+O2+H2O=HNO3
C. 轉移的電子數為0.02mol
D. 有NO氣體生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖所表示的方法研究金屬鈉與水反應的性質,其中A是用帶孔的鋁箔包著的小塊的金屬鈉.

(1)從大塊鈉上取下的小塊鈉要用濾紙擦一擦,這樣做的目的是_______________。
(2)包裹鈉塊的鋁箔要預先扎上足夠多的小孔,若孔數不夠,可能出現的不良后果是__________.假如在實驗剛開始就將鑷子松開拿出水面,A表現出的現象是 _______________________,出現這種現象的原因是______________。
(3)據預測,鈉與水反應生成氫氣和氫氧化鈉.
證明生成氫氧化鈉的實驗方法和相應的現象是______________________;
(4)已知反應結束后鋁箔和鈉均消失,請寫出相關反應的離子方程式:______________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】農藥波爾多液可用于水果滅蟲,是由石灰水和硫酸銅溶液混合而成的懸濁液。它不能用鐵制容器盛放,是因為鐵與該農藥中的硫酸銅起反應。在該反應中,對鐵的敘述錯誤的是( )
A. 鐵發生還原反應B. 鐵發生氧化反應
C. 鐵是還原劑D. 鐵失去電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com