
已知:原電池H2(g)| NaOH(aq) | HgO(s),Hg(l) 在298.15K下的標準電動勢Ey=0.926V
反應H2(g) + 1/2 O2(g) = H2O(l) rGmy(298K) = 237.2kJ?mol1
物 質 | Hg(l) | HgO(s) | O2(g) |
Smy(298K)/J?mol1?K1 | 77.1 | 73.2 | 205.0 |
2-1寫出上述原電池的電池反應與電極反應(半反應)。
2-2計算反應HgO(s)=Hg(l) + ½ O2(g) 在298.15K下的平衡分壓p(O2)和rHmy(298.15K)。
2-3設反應的焓變與熵變不隨溫度而變,求HgO固體在空氣中的分解溫度。
2-1 電極反應 () H2(g) + 2OH- = 2H2O(l) + 2e (0.5分)
電極反應 (+) HgO(s) + H2O + 2e = OH + Hg(l) (0.5分)
電池反應 H2(g) + HgO(s) = H2O(l) + Hg(l) (1分)
2-2 rGmy = nFEy = 2 X96500 C?mol1X0.926 V = 178.7 X103 J?mol1 (1分)
H2(g) + 1/2 O2(g) = H2O(l) rGmy(2) = 237.2 kJ/moL
H2(g) + HgO(s) = H2O(l) + Hg(l) rGmy(1) = 178.7 kJ/mol
HgO(s) = Hg(l) + 1/2 O2(g) rGmy(3)=rGmy(1)rGmy(2)= +58.46kJ/mol(1分)
lnKpy= (Gy/RT) = (58.46X103J/mol)/[(8.314J/mol?K)X(298.15K)] = 23.60
Kpy = 5.632X1011 (1分)
Kpy = [p(O2)/py]1/2 p(O2) = (Kpy)2Xpy =3.17X1021X101.3kPa (2分)
Hy = Gy + TSy = 58.46X103kJ/mol + 298.15KX106.7Jmol-1K1 = +90.28 kJ/mol (2分)
不計算Kpy直接得出氧的分壓p(O2)得分相同。
2-3 HgO(s) 穩定存在, p(O2) ≤ 0.21X101.3kPa.
ln(K2y/K1y)= ln(p21/2/p11/2)=1/2ln(p2/p1)=Hy/R(1/T11/T2)
1/T2=1/T1{[Rln(p2/p1)]/2Hy}=1/298.15K
[8.314Jmol1K-1ln(0.21/3.17X1021)]/2X90278Jmol-1
= 0.00125K-1
T2 = 797.6 K (3分)
其他計算方法得分相同。
算式答對,數據計算錯誤,給一半分。計算錯誤不作二次懲罰。答案中有效數字錯誤扣0.5分。


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2009-2010學年河北冀州中學高一下學期期中考試化學卷 題型:填空題
填空題
(1)下列說法中正確的是
①門捷列夫繪制出了第一張我們現在常用的元素周期表。②天然存在的同位素,相互間保持一定的比率。③元素的性質隨著原子量的遞增而呈周期性變化的規律叫做元素周期律。④燃料電池與干電池的主要差別在于反應物不同。⑤同系物之間分子量相差14。⑥由于存在化學反應的限度,所以一個化學反應在實際進行時不一定按照化學方程式的計量關系進行。⑦各種物質都儲存有化學能。⑧甲烷和氯水在光照條件下發生取代反應,產物為混合物。
(2)用鋅片、銅片連接后浸入稀硫酸溶液中,構成了原電池,工作一段時間,鋅片
的質量減少了3.25克,銅表面析出了氫氣 L(標準狀況下),導線中通過 mol電子。
(3)在25℃時,向100 mL含氯化氫14.6 g的鹽酸溶液里放入5.60 g純鐵粉(不考慮反應前后溶液體積的變化),反應開始至2 min末,收集到1.12 L(標準狀況)氫氣。在此之后,又經過4 min,鐵粉完全溶解。則: 前2 min與后4 min相比,反應速率較快的是 ,其原因是
(4)已知下列原電池的總反應式:Cu+2FeCl3==CuCl2+2FeCl2,請寫出電極反應方程式:
正極反應方程式為:
負極反應方程式為:
(5)已知斷開1 molH-H鍵、1mol Br-Br鍵、1mol H-Br鍵分別需要吸收的能量為436kJ、193kJ、366kJ.。 計算H2和Br2反應生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。
查看答案和解析>>
科目:高中化學 來源:2013年山東省臨沂市高考化學三模試卷(解析版) 題型:解答題

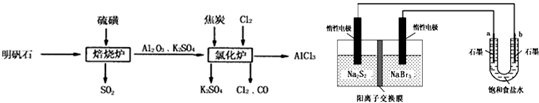
 Na2S4+3NaBr
Na2S4+3NaBr查看答案和解析>>
科目:高中化學 來源: 題型:
填空題
(1)下列說法中正確的是
①門捷列夫繪制出了第一張我們現在常用的元素周期表。②天然存在的同位素,相互間保持一定的比率。③元素的性質隨著原子量的遞增而呈周期性變化的規律叫做元素周期律。④燃料電池與干電池的主要差別在于反應物不同。⑤同系物之間分子量相差14。⑥由于存在化學反應的限度,所以一個化學反應在實際進行時不一定按照化學方程式的計量關系進行。⑦各種物質都儲存有化學能。⑧甲烷和氯水在光照條件下發生取代反應,產物為混合物。
(2)用鋅片、銅片連接后浸入稀硫酸溶液中,構成了原電池,工作一段時間,鋅片
的質量減少了3.25克,銅表面析出了氫氣 L(標準狀況下),導線中通過 mol電子。
(3)在25℃時,向100 mL含氯化氫14.6 g的鹽酸溶液里放入5.60 g純鐵粉(不考慮反應前后溶液體積的變化),反應開始至2 min末,收集到1.12 L(標準狀況)氫氣。在此之后,又經過4 min,鐵粉完全溶解。則: 前2 min與后4 min相比,反應速率較快的是 ,其原因是
(4)已知下列原電池的總反應式:Cu+2FeCl3==CuCl2+2FeCl2,請寫出電極反應方程式:
正極反應方程式為:
負極反應方程式為:
(5)已知斷開1 molH-H鍵、1mol Br-Br鍵、1mol H-Br鍵分別需要吸收的能量為436kJ、193kJ、366kJ.。 計算H2和Br2反應生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com