
【題目】某工廠生產硼砂過程中產生的固體廢料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中鎂的工藝流程如下:

部分陽離子以氫氧化物形式完全沉淀時溶液的pH如下表,請回答下列問題:
沉淀物 | Fe3+ | Al3+ | Mg2+ |
PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步驟中,為提高鎂的浸出率,可采取的措施有 (要求寫出兩條)。
(2)濾渣I的主要成分有 。
(3)從濾液Ⅱ中可回收利用的主要物質有 。
(4)若將MgCl2溶液加熱蒸干得到的固體是__________,若要得到MgCl2應采取的操作是___________。
(5)用稀硫酸酸浸時形成濾渣的離子方程式有_____________________。
【答案】(1)升高溫度、攪拌、多次浸取等(2分)
(2)Fe(OH)3 Al(OH)3(2分) (3)Na2SO4(1分)
(4) Mg(OH)2(1分) 在HCl的氣流中將MgCl2溶液加熱蒸干(2分)
(5) MgSiO3+2H+=H2SiO3+Mg2+ (2分)CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O(2分)
【解析】
試題分析:(1)浸出步驟硫酸同固體廢料中主要成份反應,從化學反應速率和化學平衡的影響因素來看,可通過升高溫度提高硫酸鎂的溶解度,或通過攪拌使反應物充分接觸反應,或通過過濾后濾渣多次浸取以提高轉化率;
(2)因MgCO3、CaMg(CO3)2、Al2O3、Fe2O3能與硫酸反應,生成了MgSO4、CaSO4、Al2(SO4)3和Fe2(SO4)3,其中CaSO4微溶,形成濾渣;濾液中含有MgSO4、Al2(SO4)3和Fe2(SO4)3,根據陽離子以氫氧化物形式完全沉淀時溶液的pH,在調節pH至5.5時,Fe3+和Al3+已經完全沉淀,濾渣I的主要成分是Fe(OH)3 Al(OH)3;
(3)上述過濾后濾液中陰離子主要是SO42-,加入NaOH后在調節pH至12.5時Mg2+完全沉淀,溶質主要成分是Na2SO4;
(4)氯化鎂水解生成氫氧化鎂和氯化氫,水解吸熱,且生成的氯化氫易揮發,因此若將MgCl2溶液加熱蒸干得到的固體是氫氧化鎂。要得到氯化鎂應采取的操作是在HCl的氣流中將MgCl2溶液加熱蒸干;
(5)由于硅酸鎂與稀硫酸反應生成硅酸沉淀,另外硫酸鈣微溶,所以用稀硫酸酸浸時形成濾渣的離子方程式有MgSiO3+2H+=H2SiO3+Mg2+、CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O。


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案科目:高中化學 來源: 題型:
【題目】某地區的自來水是采用氯氣消毒的,為了檢驗Cl-的存在,最好選用下列物質中的 ( )
A.石蕊溶液 B.四氯化碳 C.氫氧化鈉溶液 D.硝酸銀溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲~庚等元素在周期表中的相對位置如表所示。己的最高價氧化物對應水化物有強脫水性,甲和丁在同一周期,甲原子最外層與最內層具有相同電子數。下列判斷正確的是( )
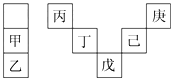
A. 丁的最高價氧化物是人類將太陽能轉換為電能的常用材料
B. 氣態氫化物的穩定性:庚<己<戊
C. 常溫下,甲和乙的單質均能與水劇烈反應
D. 丙與戊的原子序數相差28
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上由黃銅礦(主要成分CuFeS2)冶煉銅的主要流程如下:

(1)氣體A中的大氣污染物可選用下列試劑中的 吸收.
a.濃H2SO4b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈紅色,說明溶液中存在 (填離子符號),檢驗溶液中還存在Fe2+的方法是
(3)由泡銅冶煉粗銅的化學反應方程式為 .
(4)取一定量的泡銅,加入1L0.6mol/LHNO3溶液恰好完全溶解,同時放出2240mLNO氣體(標準狀況),另取等量的泡銅,用足量的H2還原,得到的銅的質量為 g.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫化亞銅(CuH)是一種不穩定的物質,能在氯氣中燃燒,也能與酸反應。用CuSO4溶液和“某物質”在40~50℃時反應可生成CuH。下列敘述中錯誤的是( )
A.“某物質”具有還原性
B.CuH與鹽酸反應可能產生H2
C.CuH與足量稀硝酸反應:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯氣中燃燒:CuH+Cl2=CuCl+HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物在氣態時與相同狀況下的H2的密度之比為30∶1,又知12.0 g該有機物與足量鈉反應放出0.2 g H2,且不能發生銀鏡反應,符合條件的有機物可能有( )
A.2種 B.3種 C.4種 D.6種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E均是短周期元素,其原子序數依次增大,A和B同周期,A和D同主族,A原子最外層電子數是內層電子數的二倍,B元素族序數是周期數的三倍,B的陰離子與C的陽離子電子層結構相同,C的單質與B的單質在不同條件下反應,可生成C2B或C2B2,E是所在周期中原子半徑最小的元素。請回答:
(1)D在元素周期表中的位置是 。
(2)C2B的電子式是 ;AB2的結構式是 。
(3)B、C、E的離子半徑由大到小的順序為 (用化學式回答,下同);A、D、E元素最高價氧化物對應水化物的酸性由強到弱為 。
(4)B的氣態氫化物與H2S相比沸點高的是 (用化學式回答);原因是 。
(5)水中錳含量超標,容易使潔具和衣物染色,使水產生異味,EB2可以用來除去水中超標的Mn2+,生成黑色沉淀MnO2,當消耗13.50gEB2時,共轉移了1mol電子,則反應的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確是
A.糖類、油脂、蛋白質完全燃燒只生成CO2和H2O
B.丁烷(C4H10)和二氯甲烷都存在同分異構體
C.向溴水中加入苯,振蕩靜置后觀察下層幾乎無色
D.汽油、柴油、植物油都是碳氫化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F是六種常見元素,其中A、B、C、D、E五種元素在周期表中的相對位置如下圖所示:
A | B | |||||
C | D | E |
其中B、F形成的二元化合物與D的單質在高溫條件下能發生置換反應,該反應可用于焊接鐵軌。
回答下列問題:
(1)E在元素周期表中的位置 。
(2)B、C兩種元素形成的既含離子鍵又含共價鍵的化合物的電子式 。
(3)工業上制備D的單質的方法是電解其 (填字母),陰極反應式為 。
a.氧化物 b.氫氧化物 c.氯化物 d.硫酸鹽
(4)常溫條件下,向20ml濃度為0.010mol/L的D的氯化物和F的最高價氯化物的混合溶液中逐滴滴入0.020mol/L的NaOH溶液,溶液的pH隨著滴入NaOH溶液的變化曲線如圖所示:

已知:D和F的最高價氧化物的水化物的溶度積分別為Ksp(D)=1.30×10-33、Ksp(F)=4.0×10-38。
①圖像中產生F的最高價氧化物的水化物的沉淀曲線為 (填字母)
a.bc段 b.cd段 c.de段 d.ef段
②沉淀量最大的點為 (填圖像中合適的字母)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com